
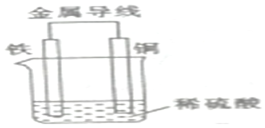
 现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:
现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:分析 (1)铵盐和氢氧化钡晶体之间的反应是吸热反应;自发地氧化还原反应可以设计成原电池;
(2)Fe-Cu原电池,铁为负极,被氧化,电极反应为Fe-2e-=Fe2+,Cu为正极,发生还原反应,电极反应为2H++2e-=H2↑,结合电极反应解答.
解答 解:(1)Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O是吸热反应,Fe+H2SO4═FeSO4+H2↑属自发的氧化还原反应,可以设计成原电池,故答案为:①;②;
(2)①Fe-Cu原电池,铁为负极,Cu为正极,溶液中H+向正极铜电极方向移动,故答案为:负极;铜;
②正极发生还原反应,电极反应为2H++2e-=H2↑,现象是有气泡产生,负极的电极反应式为Fe-2e-=Fe2+,故答案为:有气泡产生;Fe-2e-=Fe2+;
③由正极电极反应为2H++2e-=H2↑,则反应过程中有0.2mol电子发生转移,则生成的氢气在标准状况下的体积为2.24L,故答案为:2.24.
点评 本题考查原电池知识,侧重于原电池的工作原理的考查,为高考高频考点,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键,难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 放电时,NaTi2(PO4)3发生氧化反应 | |
| B. | 放电时,Na+向锌棒一极移动 | |
| C. | 充电时,阳极反应式为[Ti2(PO4)3]+-2e-=[Ti2(PO4)3]3+ | |
| D. | 充电时,每转移0.2 mol电子,阴极增重6.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b+c时,B的物质的量分数变大 | B. | 若a=b+c时,B的体积分数不变 | ||
| C. | 若a>b+c时,A的转化率变小 | D. | 若a<b+c时,A的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2与SO3互为同分异构体 | |
| B. | 氢气是理想的绿色能源 | |
| C. | 单质中不存在化学键 | |
| D. | 电解饱和氯化钠溶液可能得到金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成塔中加入3molH2与1molN2反应即可得到2molNH3 | |
| B. | 工业上合成SO3时可加入过量空气以提高SO2的转化率 | |
| C. | 利用Al、Mg、NaOH溶液、导线及电流计等可证明Al的金属活动性大于Mg的 | |
| D. | 冰箱保存的食品不易变质,与化学反应速率无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3v(N2)=v(H2) | B. | v(N2)=3v(H2) | C. | 1.5v(H2)=v(NH3) | D. | v(N2)=2v(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此配合物,中心离子的配位数为4 | |
| B. | H2O为配体,配位原子是氧原子 | |
| C. | 此配合物中,Cu2+提供孤对电子 | |
| D. | 向此配合物溶液中加入BaCl2溶液,出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 可以通过延长化学反应时间改变化学反应限度 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度不再改变 | |
| D. | 化学反应的限度不可以通过改变条件而发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a | |
| B. | 常温下0.1 mol•L-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A) | |
| C. | 室温时 M(OH)2(s)?M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b mol•L-1 时,溶液的pH为14+$\frac{1}{2}$1g$\frac{a}{b}$ | |
| D. | 0.1 mol•L-1Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com