
| A. | CH4,C2H4,C3H6任意体积比 | |
| B. | CH4,C3H6,C2H2保持C3H6:C2H2=1:2(物质的量之比) | |
| C. | C2H6,C4H6,C2H2同条件下体积比为2:1:2 | |
| D. | C3H8,C4H8,C2H2质量比为11:14:26 |
分析 设烃的混合物的平均化学式为CxHy,在氧气中燃烧的化学方程式为:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{4}$H2O(l),根据体积变化,则1:(1+$\frac{y}{4}$)=10mL:20ml,解得:y=4,即混合气体分子中平均含有4个H原子,结合选项计算判断.
解答 解:设烃的混合物的平均化学式为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{4}$H2O(l) 体积减小
1 1+$\frac{y}{4}$
10mL 20mL
则1:(1+$\frac{y}{4}$)=10mL:20mL,解得:y=4,即混合气体分子中平均含有4个H原子,
A.CH4、C2H4分子均含有4个H原子,而C3H6含有6个H原子,其混合物中氢原子的平均数不可能为4,故A错误;
B.CH4、C3H6、C2H2混合,应保持C3H6:C2H2=1:1(物质的量之比)才能满足混合物中H原子数平均为4,故B错误;
C.C2H6、C4H6、C2H2同条件下体积比为2:1:1,平均H原子数目为:$\frac{2×6+6+2}{2+1+1}$=5,故C错误;
D.C3H8、C4H8、C2H2质量比为11:14:26,则其物质的量之比为:$\frac{11}{44}$:$\frac{14}{56}$:$\frac{26}{26}$=1:1:4,平均H原子数目为:$\frac{8+8+2×4}{1+1+4}$=4,故D正确;
故选D.
点评 本题考查混合物的计算,题目难度中等,注意掌握差量法与平均分子式在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
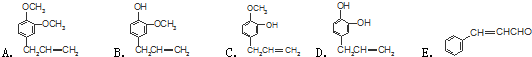
 $\stackrel{反应②}{→}$X,
$\stackrel{反应②}{→}$X,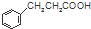 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑧ | B. | ②③④⑦ | C. | ④⑤⑥⑧ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③⑤⑥ | C. | ②④⑤⑥ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
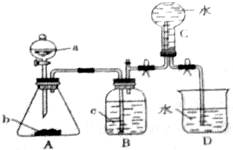
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
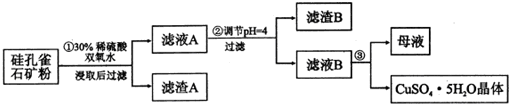
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com