
| A、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ/mol |
| B、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ/mol |
| C、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ/mol |
| D、2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ/mol |
| 22g |
| 44g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 编号 | 实验目的 | 实验设计 |
| A | 除去NO2 中少量的NO | 向混合气体中通入O2 |
| B | 除去乙酸乙酯中的乙酸杂质 | 加入氢氧化钠溶液,分液 |
| C | 证明苯分子中不含碳碳双键 | 向苯中加入酸性高锰酸钾溶液 |
| D | 证明氯元素的非金属性比硅强 | 将HCl通入Na2SiO3溶液中 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
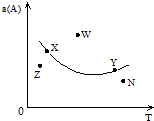 如图所示,是在其他条件一定时,反应2A+B?2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( )
如图所示,是在其他条件一定时,反应2A+B?2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( )| A、X或Y两点相应,V(正)>V(逆) |
| B、Z、N两点表示未达平衡状态,且都是V(正)>V(逆) |
| C、W点表示非平衡状态,V(正)>V(逆) |
| D、相应反应速率大小的点:W>Y>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
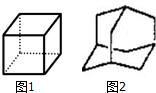 判断同分异构体的种类(不考虑立体异构):
判断同分异构体的种类(不考虑立体异构):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、用锌片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面析出铜 |
| C、把铜片插入三氯化铁溶液,在铜片表面析出铁 |
| D、把锌放入稀盐酸中,加几滴氯化铜溶液,产生气泡速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M是离子化合物,且其溶液中阴阳离子个数比为1:1 |
| B、L的悬浊液加入Q的溶液,白色沉淀可以转化为黑色沉淀 |
| C、Na2RO4水溶液可以用于杀菌消毒和净水 |
| D、Q的水溶液中加入铝与Z单质形成的化合物,只有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com