
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 64g SO2中含有的氧原子数为2NA
B. 含有6.02×1023个H原子的H2在标准状况下的体积约为22.4L
C. 40g NaOH溶解在1L水中,所制得的溶液,物质的量浓度为1mol•L﹣1
D. 标准状况下,11.2L H2O含有的分子数为0.5NA
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A.64g二氧化硫的物质的量为1mol,1mol二氧化硫中含有2mol氧原子;
B.含有6.02×1023个H原子的H2的物质的量为0.5mol;
C.氢氧化钠溶于1L水中,所得溶液的体积不是1L;
D.标准状况下,所得状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量.
解答: 解:A.64g二氧化硫的物质的量为1mol,含有2mol氧原子,含有的氧原子数为2NA,故A正确;
B.6.02×1023个H原子的物质的量为1mol,需要0.5mol氢气,标况下0.5mol氢气的体积为11.2L,故B错误;
C.40g氢氧化钠的物质的量为1mol,1mol氢氧化钠溶于1L水中,所得溶液的体积不是1L,溶液的浓度不是1mol/L,故C错误;
D.标况下,水不是气体,不能使用标况下的气体摩尔体积计算11.2L水的物质的量,故D错误;
故选A.
点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下水的状态不是气体,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C为易错点,注意所得溶液的体积不是1L.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
下列实验方案设计中,可行的是()
A. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物
D. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.6g Na投入到95.6g水中,所得溶液中溶质的质量分数为( )
A. 小于4.6% B. 等于8.0% C. 小于8.0% D. 大于8.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)等质量的O2、CH4、H2的物质的量的比值为 .
38g某二价金属氯化物(ACl2)中含有0.8mol Cl﹣,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是 .
(3)新制备的氯水显 色,说明氯水中有 (填分子式)分子存在.
(4)向氯水中滴加几滴AgNO3溶液,立即有 生成,说明氯水中有 (填离子符号)存在,反应的化学方程式为 氯水光照后颜色变浅,并放出 气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时将pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水(若混合体积变化忽略不计),则下列有关所得混合液说法正确的是()
A. 混合后溶液pH=7
B. 所得混合溶液中c(Na+)>c(CH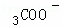 )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
C. 所得混合溶液中存在c(CH3COOH)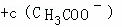 =0.05mol/L
=0.05mol/L
D. 混合后溶液中存在c(Na+)+c(H+)=
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:L(s)+aG(g)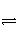
 bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。据此可判断( )
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。据此可判断( )
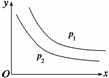
①上述反应是放热反应②上述反应是吸热反应③a>b④a<b
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.碳与二氧化碳反应既是吸热反应,又是化合反应
C.热化学方程式中化学计量系数可表示分子个数
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com