
下列有关工业生产的叙述正确的是
A.合成氨工业中,将NH3及时液化分离有利于加快反应速率
B.氯碱工业中,使用离子交换膜可防止C12和NaOH溶液反应
C.硫酸工业中,接触室内安装热交换器,是为了利用沸腾炉中排出的SO2的热量
D.硫酸工业中,SO2的催化氧化不采用高压,是因为压强对SO2转化率无影响
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届江西五校高三第一次联考化学试卷(解析版) 题型:选择题
某有机物的结构简式如图: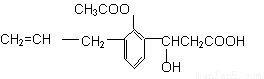 则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和
则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和
A.①②③⑤⑥ B.②③④⑤⑥ C.①②③④⑤⑥ D.①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
A.平衡向逆反应方向移动 B.A的转化率降低
C.m+n>p D.C的体积分数减小
查看答案和解析>>
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
根据四种变化:①Fe(s)→Fe(g);②2H2(g)+ O2(g)=2H2O(g) △H=-482 kJ·mol-1;
③C(s)+CO2(g)=2CO(g);④NaOH(s)=Na+(aq)+OH-(aq)。 请回答下列问题
⑴上述变化中,需要吸收热量的是 (请填变化的代码①②③④,下同)。
⑵上述变化中,体系的混乱度增大的是 。
⑶已知下列两种键能,H-H:436 kJ·mol-1、O-H:463 kJ·mol-1,请计算断裂1 molO2(g)中的共价键需要吸收 kJ的能量。
⑷下面几种说法中。正确的是 [
A.化合反应都大多是放热反应
B.凡是需要加热的反应,都是吸热反应
C.体系的混乱度增大的反应都是吸热反应
D.中和反应是放热反应,其化学能可以转化成电能
查看答案和解析>>
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
利用如图所示装置可以模拟钢铁的电化学防护。下列说法正确的是

A.若X为锌棒,开关K置于M处,铁极发生还原反应
B.若X为碳棒,开关K置于N处,X极发生还原反应
C.若X为碳棒,开关K置于N处,可加快铁的腐蚀
D.若X为锌棒,开关K置于M处,可加快铁的腐蚀
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:填空题
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
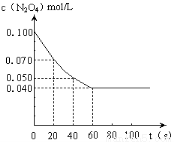
(1)计算在20至40秒时间内,NO2的平均生成速率为 mol?L-1?S -1。
(2)①该反应的化学平衡常数表达式为 。
②求该温度下平衡常数的值。(写出计算过程,下同)
(3)求达到平衡状态时N2O4的转化率。
(4)求平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为: Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:填空题
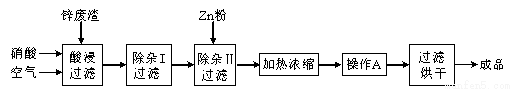
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
⑴在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为 。为使Fe(OH)3 、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 。检验Fe3+是否沉淀完全的实验操作是 。
⑷加入Zn粉的作用是 。“操作A”的名称是 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:实验题
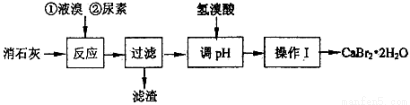
(15分)溴化钙在医药上用作中枢神经抑制药,实验室用“尿素法”制备溴化钙的主要流程如下:
溴化钙的部分溶解度数值如下:
温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(1)6Ca(OH)2+6Br2 50~70℃ 5CaBr2+6H2O+Ca(BrO3)2,每生成1 mol Ca(BrO3)2转移电子的物质的量为 ;50~70℃时,尿素[CO(NH2)2]将生成的Ca(BrO3)2还原为CaBr2,尿素被氧化为N2,该反应的化学方程式为 。
(2)过滤所需的玻璃仪器有玻璃棒、,。
(3)加入氢溴酸调pH的作用是。
(4)操作I包括、、过滤、、干燥。
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案。
限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com