
| A. | ①④⑧ | B. | ⑤⑧ | C. | ②⑤⑥⑦ | D. | ③ |
分析 ①HClO有强氧化性,能将HSO3-氧化;
②碘酸中的碘离子有还原性,会将Fe3+还原;
③重水的摩尔质量为20g/mol,1.8g重水的物质的量为0.09mol,重水中含有10个质子、10个电子;
④气体状况未知,无法计算其物质的量;
⑤根据醋酸是弱电解质,稀释后pH变化较小进行判断;
⑥依据实验室制备氢氧化铁胶体的方法解答;
⑦葡萄糖为多羟基醛,含有醛基;
⑧甲醛能制取酚醛树脂,乙二醇可以生成酯类高聚物;
解答 解:①NaClO溶液中通入过量SO2气体,发生氧化还原反应生成硫酸根离子和氯离子,故错误;
②碘酸中的碘离子有还原性,会将Fe3+还原,溶液中三价铁离子与碘离子不会共存,故错误;
③A、1.8g重水的物质的量为0.09mol,0.09mol重水中含有0.9mol质子、0.9mol电子,含有的质子数和电子数均为0.9NA,故错误;
④气体状况未知,无法计算其物质的量,无法计算转移电子数,故错误;
⑤用量筒、试管、胶头滴管、玻璃棒、蒸馏水和PH试纸,可鉴别pH相等的硫酸和醋酸,根据醋酸是弱酸,稀释后溶液的pH变化较小;而盐酸是强酸,稀释后溶液的pH变化大,可以鉴别pH相等的硫酸和醋酸,故正确;氯化铁在溶液中水解生成氢氧化铁,加热促进水解,煮沸会出现红褐色沉淀,得到的是氢氧化铁沉淀,故A正确;
⑥制备氢氧化铁胶体时:将小烧杯中25mL蒸馏水加至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热,故错误;
⑦乙醛与葡萄糖中均含有醛基,均能与银氨溶液反应,故不能鉴别,故错误;
⑧甲醛与苯酚聚合生成酚醛树脂,乙二醇中含有羟基,能与羧酸发生缩聚反应生成高聚物,故正确;
故选:B.
点评 本题为综合题,考查了离子方程式书写判断、阿伏伽德罗常数的应用、有机物的性质,题目难度不大,注意氢氧化铁胶体制备方法.


科目:高中化学 来源: 题型:选择题
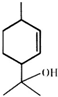
| A. | 松油醇的分子式为C10H16O | |
| B. | 1 mol松油醇与足量金属钠反应可生成标准状况下的H2 22.4L | |
| C. | 可以用酸性高锰酸钾溶液鉴别苯乙烯和松油醇 | |
| D. | 松油醇能发生加成反应、氧化反应、酯化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 防止“地沟油”重上餐桌的方法之一是将其制成生物柴油,在汽油中添加20%的生物柴油可减少50%的CO2、70%的SO2的排放,空气毒性可降低90% | |
| B. | 北京市600个居住小区率先进行垃圾分类试点,以促进垃圾的综合利用 | |
| C. | 减少CO2的方法有可将CO2制成干冰用于人工降雨、用石灰水吸收CO2、将CO2制成甲醇、种植树木吸收CO2等 | |
| D. | 限制化学发展,关停化工企业,消除污染源头 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| B. | SO2具有氧化性,因此可用于漂白纸浆 | |
| C. | 植物油和裂化汽油都能使溴水褪色 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol甲基(14C1H3-)所含的中子数和电子数分别为8NA、10NA | |
| B. | 标准状况下,11.2L五氯化磷中含有P-Cl键的数目为2.5NA | |
| C. | 标准状况下,2.24L Cl2全部被NaOH溶液吸收,转移的电子数目为0.2NA | |
| D. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只有1种结构 | |
| B. | 雌性信息素可能是烯烃,会使溴水褪色 | |
| C. | 电解的阳极反应式为:C21H41COOH+X+2H2O-2e-→C23H46+2CO32-+6H+ | |
| D. | 阴极的还原产物为H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的性质较稳定,在自然界中存在游离态的硅 | |
| B. | 陶瓷、水泥、玻璃、金刚砂均为传统无机非金属材料 | |
| C. | 水泥、普通玻璃的制备均要用到石灰石 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱溶液无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com