
 铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:
铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:分析 (1)Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
(2)Fe(CO)x常温下呈液态,熔沸点低可判断Fe(CO)x晶体属于分子晶体;原子数目相等、价电子总数相等的微粒互为等电子体;
(3)[Co(CN)6]4-具有强还原性,能与水反应生成[Co(CN)6]3-与氢气,根据原子守恒与电荷守恒可知还有OH-生成;
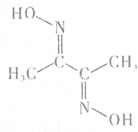
(4)自然界的镍矿中含有大量氧化镍,其晶体结构与NaCl相同,一个钠离子周围6个氯离子,所以晶体中Ni2+的配位数为6;分子单键的数目为13个,双键数目为2,所以分子中σ键与π键的数目比为15:2;甲基中的碳是sp3杂化,双键两端的碳是sp2杂化;
(5)金属镍原子的堆积方式为面心立方最密堆积,即镍原子位于晶胞立方体的顶点和面心上,所以晶胞的面对角线等于镍原子半径的4倍,所以晶胞的边长应为面对角线的$\frac{\sqrt{2}}{2}$,据此计算铜晶胞的体积.
解答 解:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,则M层电子排布式为:3s23p63d5,
故答案为:3s23p63d5;
(2)Fe(CO)x常温下呈液态,熔沸点低可判断Fe(CO)x晶体属于分子晶体;原子数目相等、价电子总数相等的微粒互为等电子体,与CO互为等电子体的离子有CN-、C22-,
故答案为:分子晶体;CN-、C22-;
(3)[Co(CN)6]4-具有强还原性,能与水反应生成[Co(CN)6]3-与氢气,根据原子守恒与电荷守恒可知还有OH-生成,反应离子方程式为:2[Co(CN)6]4-+2H2O═2[Co(CN)6]3-+H2↑+2OH-,加人BaCl2 溶液无明显现象,说明硫酸根离子是内界,所以电离方程式为:Co(NH3)5BrSO4=[Co(NH3)5SO4]++Br-
,故答案为:2[Co(CN)6]4-+2H2O═2[Co(CN)6]3-+H2↑+2OH-;Co(NH3)5BrSO4=[Co(NH3)5SO4]++Br-;
(4)自然界的镍矿中含有大量氧化镍,其晶体结构与NaCl相同,一个钠离子周围6个氯离子,所以晶体中Ni2+的配位数为6;分子单键的数目为13个,双键数目为2,所以分子中σ键与π键的数目比为15:2;甲基中的碳是sp3杂化,双键两端的碳是sp2杂化,故答案为:6;15:2;sp2和sp3;
(5)镍的晶胞为面心立方最密堆积,以顶点镍原子研究,与之最近的镍原子位于面心上,每个顶点镍原子为12个面共用,所以镍的配位数为12,晶胞中含有镍原子数为$8×\frac{1}{8}$+6×$\frac{1}{2}$=4,设晶胞的边长为a cm,则a3•ρ•NA=4×59,所以a=$\root{3}{\frac{236}{ρ•{N}_{A}}}$,由于面对角线为$\sqrt{2}$a,面对角线的$\frac{1}{4}$为镍原子半径,所以镍原子半径为$\frac{\sqrt{2}}{4}$acm=$\frac{\sqrt{2}}{4}$$\root{3}{\frac{236}{ρ•{N}_{A}}}$×10-10,故答案为:$\frac{\sqrt{2}}{4}$$\root{3}{\frac{236}{ρ•{N}_{A}}}$×10-10.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,侧重考查了晶胞的结构和晶胞的计算,注意均摊法的应用,对学生的观察能力和空间想象能力有较高的要求,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
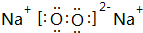 ,其中含有的化学键为离子键和共价键.
,其中含有的化学键为离子键和共价键.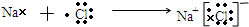 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
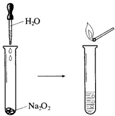 Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.
Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn是正极,Ag2O是负极 | B. | 负极反应为Zn+2OH--2e-=Zn(OH)2 | ||
| C. | 工作时负极区溶液的pH增大 | D. | 工作时溶液中K+移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
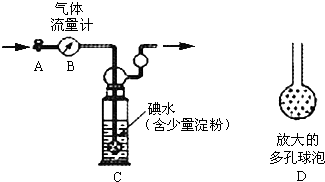 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com