
【题目】氯化钠是家庭日常生活中必不可少的一种调味品,海水制盐是氯化钠来源的一种途径。海水晒盐工业流程中,得到的粗盐常含有Mg2+、Ca2+、SO42-等杂质工业提纯粗盐的流程如图所示:

(1)步骤④操作中需要用到玻璃棒,玻璃棒的作用是____________;步骤⑥中操作b实验室用到的可直接加热的仪器名称叫____________。
(2)如果按以上操作步骤及顺序进行了,则制得的精盐不纯。要获得纯净的精盐,还需添加的试剂是(填化学式)____________;该步骤作应该放在(填序号)____________之前。
(3)室温下,电解1mol/L500mL的NaCl溶液,当溶液的pH=13时停止电解;写出该电解过程的离子方程式(忽略溶液体积变化,惰性电极):________________________________________________________;
要使电解后的溶液恢复到原浓度,需加入(通入)____________mol____________(填物质名称)。
(4)用氯碱工业的产物氢氧化钠配制成0.1mol/L的标准溶液,滴定20mL未知浓度的盐酸溶液,需用作____指示剂,判定要达到滴定终点的现象:_________________________________。
【答案】引流 蒸发皿 BaCl2[或Ba(OH)2] 之后②或③(填②或③也正确) 2Cl-+2H2O![]() H2↑+Cl2↑+2OH- 0.05 氯化氢气体 酚酞 滴入一滴NaOH溶液,溶液颜色迅速由无色变为粉红色,且半分钟内不变色
H2↑+Cl2↑+2OH- 0.05 氯化氢气体 酚酞 滴入一滴NaOH溶液,溶液颜色迅速由无色变为粉红色,且半分钟内不变色
【解析】
根据氯碱工业反应原理分析解答;根据物质的分离和提纯方法分析解答;根据酸碱中和滴定原理分析解答。
(1)步骤④操作a是过滤,过滤中需要用到玻璃棒,玻璃棒的作用是引流;步骤⑥中操作b的名称是蒸发,实验室蒸发溶剂用到的仪器是蒸发皿;
故答案为:引流,蒸发皿;
(2)除去SO42-所以选用BaCl2[或Ba(OH)2],前面加的碳酸根由于除去过量的Ca2+时,同时也能除去过量的Ba2+,所以BaCl2放在②或③前面;
故答案为:BaCl2[或Ba(OH)2],之后②或③(填②或③也正确);
(3)电解氯化钠溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-;电解结束pH=13时,即c(OH-)=0.1mol/L,n(OH-)=0.1mol/L×0.5L=0.05mol,则生成氢氧化钠0.05mol,所以中和0.05mol氢氧化钠需HCl气体0.05mol;
H2↑+Cl2↑+2OH-;电解结束pH=13时,即c(OH-)=0.1mol/L,n(OH-)=0.1mol/L×0.5L=0.05mol,则生成氢氧化钠0.05mol,所以中和0.05mol氢氧化钠需HCl气体0.05mol;
故答案为:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-,0.05;
H2↑+Cl2↑+2OH-,0.05;
(4) 用氢氧化钠溶液,滴定20mL未知浓度的盐酸溶液,生成氯化钠溶液显碱性,用酚酞作指示剂,且滴入一滴NaOH溶液,溶液颜色迅速由无色变为粉红色,且半分钟内不变色,说明达到滴定终点;
故答案为:滴入一滴NaOH溶液,溶液颜色迅速由无色变为粉红色,且半分钟内不变色。


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:

(1)有机物D的一种合成路线如下:

已知:
(R、R表示烃基或氢)
①由C2H4生成A的化学方程式是________。
②试剂a是________
③写出B中所含官能团的名称________。
④有机物D的结构简式是________。
(2)增塑剂(DEHCH)的合成路线如下:
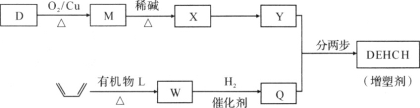
已知:
⑤D→M的化学方程式是________。
⑥有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是________。
⑦以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:

中间产物的结构简式是________,反应a的反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮、硫污染物的治理是环保的一项重要工作。
(1)①N2(g)+O2(g)═2NO(g) △H1
②2C(s)+O2(g)═2CO(g) △H2
③C(s)+O2(g)═CO2(g) △H3
则2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_______________(用△H1、△H2、△H3表示)。
(2)工业上常用醋酸二氨合亚铜 [Cu(NH3) 2] AC溶液(AC为CH3COO-)来吸收某合成气中的CO,其反应为:[Cu(NH3) 2] AC(aq)+NH3(g)+CO(g) ![]() [Cu(NH3)3] AC CO(aq) △H<0常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3) 2] AC溶液的措施是________________;
[Cu(NH3)3] AC CO(aq) △H<0常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3) 2] AC溶液的措施是________________;
(3)用天然气制取H2的其原理为:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 。在密闭容器中通入物质的量均为0.1mol的CH4与CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:压强P1_____P2(填 “大于”或“小于”),理由是____________________,压强为P2时,在Y点:v(正)_________v(逆)(填“大于”、“小于”或“等于”)。
2CO(g)+2H2(g) 。在密闭容器中通入物质的量均为0.1mol的CH4与CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:压强P1_____P2(填 “大于”或“小于”),理由是____________________,压强为P2时,在Y点:v(正)_________v(逆)(填“大于”、“小于”或“等于”)。

(4)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离平衡常数Ka=9.6×10﹣4,NaNO2溶液中存在平衡NO2- +H2O![]() HNO2 +OH- 其水解平衡常数Kh=5.0×10﹣11 则该温度下水的离子积常数KW=______。
HNO2 +OH- 其水解平衡常数Kh=5.0×10﹣11 则该温度下水的离子积常数KW=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以LiPF6和SO(CH3)2为电解质的高能锂电池的总反应式为2Li+FeS=Fe+LiS,用该电池为电源进行如图的电解实验,电解一段时间测得甲电池产生标准状况下H24.48L。下列有关叙述正确的是

A. Y电极为高能锂电池的负极从隔膜中通过的离子数目为0.4NA
B. 电解池中换成阴离子交换膜,总反应不发生变化
C. 若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4mol/L
D. 电源正极反应式为:FeS+2Li++2e-=Fe+Li2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在现用周期表中氧族元素包括 ______________________(填元素名称)五种元素,其中Se的基态原子的电子排布式为______________________,元素X与Se同周期,X元素原子核外未成对电子数最多,X为______________________(填元素符号)。
(2)与氧同周期的相邻元素中,第一电离能有大到小的顺序______________________。
(3)臭鼬排放的臭气主要成分为3—MBT(3—甲基—2—丁烯硫醇,结构如图)。1mol3—MBT中含有σ键数目为____________(NA为阿佛加德罗常数的值)。沸点:3—MBT____________(CH3)2C==CHCH2OH(填“>”“<”或“=”),主要原因是________________________。

(4)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法正确的是__________(填序号)。
A.中心原子的价层电子对数不相等
B.都是极性分子
C.中心原子的核对电子数目不相等
D.都含有极性键
②SO3分子的空间构型为__________,与其互为等电子体的阴离子为__________(举一例)。
(5)单质Po是有__________键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为rpm,阿伏加德罗常数的值为NA,则钋晶体的密度的表达式为____________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、 铜及其化合物在工业上有重要用途, 回答下列问题:
(1) 请补充完基态Co的简化电子排布式: [Ar]_________, Co2+有_______个未成对电子。
(2) Na3[Co(NO2)6]常用作检验K+的试剂, 配位体NO2-的中心原子的杂化形式为________, 空间构型为_____。大π键可用符号![]() 表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为
表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为![]() ),则NO2-中大π键应表示为____________。
),则NO2-中大π键应表示为____________。
(3) 配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ), 是铜的一种重要化合物。其中 En 是乙二胺(H2NCH2CH2NH2)的简写。
①该配合物[Cu(En)2]SO4中N、 O、 Cu的第一电离能由小到大的顺序是______________。
②乙二胺和三甲胺[N(CH3)3]均属于胺, 且相对分子质量相近, 但乙二胺比三甲胺的沸点高得多, 原因是______________________________________________________。

(4) 金属Cu晶体中的原子堆积方式如图所示, 其配位数为______, 铜的原子半径为a nm, 阿伏加德罗常数的值为NA, Cu的密度为_________g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在常温下,有硫酸和盐酸的混合液20 mL,向该溶液中加入0.05 mol/L的Ba(OH)2时,生成的BaSO4沉淀的质量和混合溶液的pH有如图所示关系。计算:

①最初混合溶液中硫酸和盐酸的物质的量浓度。_____________
②A点溶液的pH值。_________________
(2)某温度时,Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,试求:
①在该某温度时AgCl的溶解度;(![]() =1.34,结果保留一位有效数字)_______________
=1.34,结果保留一位有效数字)_______________
②若把足量的AgCl固体分别放入①100 mL H2O ②100 mL 0.1 mol/L NaCl溶液 ③100 mL 0.1 mol/L AlCl3溶液 ④100 mL 0.1 mol/L MgCl2溶液,搅拌后溶解达到平衡,在相同温度下,求各溶液中Ag+浓度由大到小的顺序。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制0.5 mol·L-1 FeSO4溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用_____________________________。
该实验小组做如下实验。
实验序号 | 操作及现象 |
ⅰ | 取2 mL上述FeSO4溶液于试管中,逐滴加入少量0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
ⅱ | 取2 mL上述FeSO4溶液于试管中,加入2滴1 mol·L-1 KSCN溶液无现象,通入一段时间O2,溶液变为浅红色 |
ⅲ | 重复实验ⅱ,向浅红色溶液中加入5% H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是FeS。Na2S 溶液呈碱性,FeSO4溶液与其反应不生成Fe(OH) 2而生成FeS的可能原因是_____________________。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:___________、_____________。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a. Fe3+ 被H2O2还原 b. SCN- 被O2氧化 c. SCN- 被H2O2氧化
乙同学根据上述实验现象认为假设b不成立,他依据的现象是________________。
甲同学利用上述部分试剂,通过以下实验验证了假设c成立。请将以下实验操作及现象补充完整。
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加FeCl3溶液 | ①_________ |
ii | ② _________________ | ③_________ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

① C、D中的溶液依次是__________、________(填字母标号)。
a.品红溶液 b.NaOH溶液 c.BaCl2 溶液
d.Ba(NO3)2 溶液 e.浓H2SO4
② C、D中有气泡冒出,并可观察到的现象分别是____________ 、______________。
③ 写出硫酸亚铁高温分解反应的化学方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com