
据ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
A. 20Ne和22Ne互为同位素
B. 20Ne和22Ne互为同分异构体
C. 20Ne和22Ne的质量数相同
D. 20Ne和22Ne的中子数相同
科目:高中化学 来源:2015-2016学年吉林省高一下期末化学试卷(解析版) 题型:选择题
下列生产或实验事实引出的相应结论不正确的是
事实 | 结论 | |
A | 常温下N2很难与金属化合 | N2分子中共价键强,N2性质稳定 |
B | 葡萄糖在空气中燃烧时需要较高温度,在人体中,正常体温就可以被氧化 | 当其他条件不变时,提高反应温度可加快反应速率 |
C | KI晶体和HgCl2晶体混合后,无明显现象,若一起投入到水中,很快生成红色HgI2 | 当其他条件不变时,增大反应物接触面积可加快反应速率 |
D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入MnO2 粉末,B试管中产生气泡快 | 当其他条件不变时,催化剂可以加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一下期末化学试卷(解析版) 题型:填空题
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
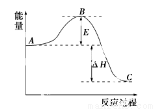
请回答下列问题:
(1)图中A、C分别表示________、________;
(2)图中ΔH=________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式: ; 。
(4)在一定条件下,向体积为2L的容器中加入2mol O2和3mol SO2进行可逆反应: 2SO2(g)+O2(g) 2SO3(g),2min后测得O2的物质的量为1.6mol,则:若用O2的浓度变化来表示该反应的反应速率,则V(O2)= ;若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
2SO3(g),2min后测得O2的物质的量为1.6mol,则:若用O2的浓度变化来表示该反应的反应速率,则V(O2)= ;若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
(5)已知单质硫的燃烧热为296 kJ·mol-1,写出由S(s)生成3 mol SO3(g)的热化学方程式(要求写出简单计算过程)。(已知燃烧热是指25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一下期末化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法中正确的是
A.0.5 mol苯分子中含有C=C双键数目为1.5 NA
B.常温常压下,17 g 羟基含有的电子总数为9NA
C.标准状况下,11.2 L CHCl3 中含有的共价键数目为2NA
D.将1 mol蔗糖与稀H2SO4混合使之完全水解,可生成2NA个葡萄糖分子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一下期末化学试卷(解析版) 题型:选择题
将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
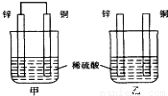
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.甲、乙溶液均变蓝色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆哈密二中高二下期末化学试卷(解析版) 题型:填空题
I.雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g) 2NO(g) △H1= a kJ·mol-1
2NO(g) △H1= a kJ·mol-1
②2NO(g)+O2(g) 2NO2(g) △H2= b kJ·mol-1
2NO2(g) △H2= b kJ·mol-1
③CO(g)+1/2 O2(g) CO2(g) △H3= c kJ·mol-1
CO2(g) △H3= c kJ·mol-1
④2CO(g)+2NO(g) N2(g)+2CO2(g) △H4
N2(g)+2CO2(g) △H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4= kJ·mol-1。
(2)下列情况能说明反应②已达平衡状态的是 (填编号)。
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.混合气体的颜色保持不变
D.在恒温恒压的容器中,NO的体积分数保持不变
II.甲醇是重要的化工原料,又可作为燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
化学反应 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应②是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正 v逆(填“>”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。
下列说法正确的是___________________(填序号)。

A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
(5)新型高效的甲醇燃料电池采用铂为电极材料,两电极上分别通入CH3OH和O2。某研究小组将两个甲醇燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
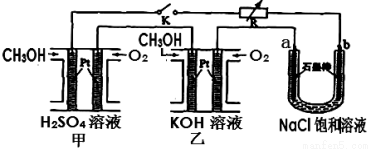
则乙燃料电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二下期末化学试卷(解析版) 题型:填空题
I.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
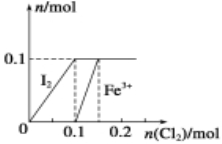
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
__________________________________________;
__________________________________________;
__________________________________________。
(3)当溶液中n(Cl-)∶n(IO3-)=13∶2时,通入的Cl2在标准状况下的体积为________。
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:

(1)写出“氧化”过程中生成Na2FeO4的离子方程式 。
(2)“转化”过程中发生的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高一下期末化学试卷(解析版) 题型:选择题
恒温恒容密闭容器中,能够表明反应A(s)+3B(g) 2C(g)+D(g)已达平衡的是( )
2C(g)+D(g)已达平衡的是( )
①混合气体的压强不变;
②混合气体的密度不变;
③B的物质的量浓度不变;
④容器内B、C、D三种气体的浓度比为3:2:1;
⑤混合气体的相对分子质量不变;
⑥消耗3molB的同时生成2molC
A.①②③ B.②③ ④ C.②③⑤ D.①③⑥
④ C.②③⑤ D.①③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com