
【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
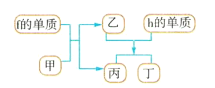
请写出h的单质与乙反应的化学方程式:___。
【答案】 CO2 2Na+O2
CO2 2Na+O2![]() Na2O2 Cl->O2->Mg2+ 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
Na2O2 Cl->O2->Mg2+ 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
【解析】
根据a~n这10种元素在周期表中的位置可判断,它们分别是H、C、N、O、Ne、Na、Mg、Al、S、Cl,
(1)S2-的核电荷数为16,核外电子数为18,故其结构示意图为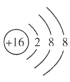 ;
;
(2)b为C,其最高价氧化物是CO2;Na在空气中受热生成Na2O2,其化学方程式为:2Na+O2![]() Na2O2;
Na2O2;
(3)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,Cl-核外有3个电子层,Mg2+与O2-核外有2个电子层,且二者电子层结构相同,则d、g、n形成的简单离子的半径由大到小的顺序为![]() ;
;
(4)常见10电子微粒有CH4、NH3、H2O、HF等,f为Na,h为Al,Na与某10电子微粒反应的产物能与Al反应,则甲为H2O,则乙为NaOH,丙为H2,Al与NaOH反应生成![]() 和H2,丁是
和H2,丁是![]() ,Al与NaOH反应的化学方程式为:
,Al与NaOH反应的化学方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:HUr(aq) + Na+ (aq)NaUr(s) + H+(aq)ΔH<0,下列说法不正确的是
A.炎热的夏季更易诱发关节疼痛
B.饮食中摄入过多食盐,会加重痛风病病情
C.患痛风病的人应少吃能代谢产生更多尿酸(HUr)的食物
D.大量饮水使 ![]() 增大,痛风病发作的可能性减小
增大,痛风病发作的可能性减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在A处通入氯气,关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C处的红布条逐渐褪色.有以下几种溶液,则D瓶中盛放的溶液可能是
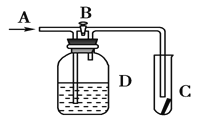
①浓硫酸 ②NaOH溶液 ③H2O ④饱和氯化钠溶液
A.①③B.①②C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加0.1 mol·L-1盐酸,溶液中由水电离出的c(H+)随加入盐酸体积的变化如图所示。则下列说法正确的是( )
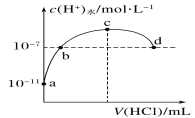
A.c点溶液中,c(NH![]() )=c(Cl-)
)=c(Cl-)
B.a、b之间的任意一点:c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.b、d两点溶液pH均为7
D.b、c、d任意一点都有: c(NH![]() )+c(H+)=c(OH-)+ c(Cl-)
)+c(H+)=c(OH-)+ c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油裂化可以提高汽油等轻质油的产量和质量
B.分子式为C5H12的同分异构体共有3种
C.向2mL碘水中加入1mL苯,振荡后静置,可观察到液体分层,上层呈紫红色
D.煤中含有苯和甲苯,可用干馏的方法将它们分离开来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国科学家研制出以石墨烯为载体的催化剂,在 25℃下用 H2O2 直接将 CH4转化为含氧有机物,其主要原理如下图所示:
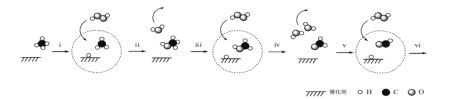
下列说法不正确的是
A.上图中 ![]() 代表 H2O2
代表 H2O2
B.由上图可知,步骤 iv 生成的 H2O,其中的 H 原子全部来自 H2O2
C.步骤 i、ii 的总反应方程式是CH4+H2O2![]() CH3OH+H2O
CH3OH+H2O
D.根据以上原理,推测步骤 vi 生成 HCOOH 和 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向如图所示的两个容积相同的刚性容器中分别充入气体M、N(如表所示),使两容器中压强相等。打开开关k,两容器中的气体充分混合后,恢复至常温,容器内的气体压强(固体影响忽略不计)由大到小的顺序正确的是 ( )
装置 | 编号 |
|
|
|
|
| M | NH3 | HI | NO | H2 |
N | Cl2 | Cl2 | O2 | O2 |
A.①=④>②=③ B.①=④>②>③
C.④>①>②>③D.①>④>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-)
D.④中:c(![]() ) + 2c(
) + 2c(![]() ) + c(H2CO3) 0.1 mol/L
) + c(H2CO3) 0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10 mol/L的氨水滴定10.0 mLa mol/L的盐酸,溶液的pH与氨水体积(V)的关系如图所示。已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是( )
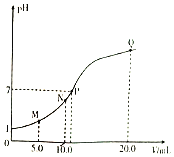
A.a=0.10
B.N、P两点溶液中水的电离程度:N<P
C.M、N两点溶液中NH4+的物质的量之比大于1:2
D.Q点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com