
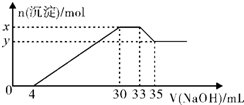
 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示.下列叙述错误的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示.下列叙述错误的是( )| A、x与y的差值为0.01mol |
| B、原溶液中c(Cl-)=0.85mol?L-1 |
| C、原溶液的c(H+)=0.1mol?L-1 |
| D、原溶液中n(Mg2+):n(Al3+)=5:1 |
| 0.004L×5mol/L |
| 0.2L |
| (0.033-0.03)L×5mol/L |
| 0.2L |
| ||
| 0.2L |
| 0.002L×5mol/L |
| 0.2L |
| 0.004L×5mol/L |
| 0.2L |
| (0.033-0.03)L×5mol/L |
| 0.2L |
| ||
| 0.2L |
| 0.002L×5mol/L |
| 0.2L |
| 0.004L×5mol/L |
| 0.2L |


科目:高中化学 来源: 题型:

| A、甲中a的电极反应式为4OH--4e-=O2↑+2H2O |
| B、电解时向乙中滴入酚酞溶液,c电极附近首先变红 |
| C、电解后向乙中加入适量盐酸,溶液组成可以恢复原状 |
| D、当b极有64 g Cu析出时,c电极产生2 g气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b=2a | B、a=2b |
| C、b>2a | D、b<2a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1.7g NH3含有NA个电子 |
| B、标准状况下,22.4L水中含H2O分子NA个 |
| C、1molNa完全反应生成NaCl时,失去NA个电子 |
| D、常温常压下,22.4LCO2中含有的CO2分子数小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g钠与足量水反应,生成Na+离子的数目为0.1NA |
| B、标准状况下,22.4L CH3CH2OH中含有的分子数为NA |
| C、27g铝与足量盐酸溶液反应转移的电子数NA |
| D、1L 1 mol?L-1BaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
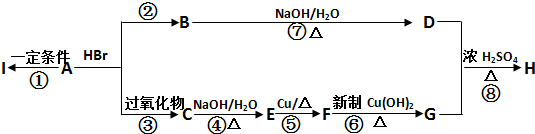
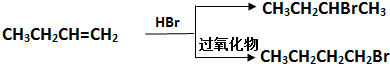
| NaOH/H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2S+SO2→3S↓+2H2O |
| B、SO2+2Mg→2MgO+S |
| C、Cl2+SO2+2H2O→H2SO4+2HCl |
| D、SO2+2NaOH→Na2SO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 mol/(L?s) |
| B、0.4 mol/(L?s) |
| C、2 mol/(L?s) |
| D、0.2 mol/(L?s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com