
 某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题:
某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题:分析 (1)碳酸氢铵受热分解产生氨气、水和二氧化碳;浓氨水受热易挥发出氨气;
(2)氨气显碱性可以和酸反应生成对应的盐;
(3)氨的催化氧化生成一氧化氮和水,该反应属于放热反应;
(4)Cu与稀硝酸反应生成硝酸铜和NO、水;酸性条件下,硝酸根离子和Cu能反应;
(5)先判断溶液中的溶质,根据钠原子守恒计算过氧化钠的物质的量;盐酸与碳酸钠反应生成的二氧化碳与碳酸氢铵分解生成的二氧化碳相同,根据反应方程式判断二氧化碳和水及过氧化钠之间的关系式,从而计算二氧化碳的体积;
(6)二氧化氮和水反应,为防止倒吸可以在装置E、F之间增加一个防倒吸装置,铜和硝酸反应的产物一氧化氮以及生成的二氧化氮均有毒,应加一个尾气吸收装置.
解答 解:(1)根据题意:C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解,说明有硝酸生成,所以A中获得的是氨气,加热NH4HCO3分解可以产生氨气,浓氨水受热易挥发出氨气,所以ad正确;
故答案为:ad;
(2)氨气显碱性可以和硫酸反应生成硫酸铵,即2NH3+H2SO4=(NH4)2SO4,
故答案为:2NH3+H2SO4=(NH4)2SO4;
(3)氨在铂丝网的作用下发生催化氧化反应生成一氧化氮和水,方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;该反应属于放热反应,所以撤去酒精灯,铂丝仍保持红热;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;该反应为放热反应;
(4)氨在铂丝网的作用下发生催化氧化反应生成一氧化氮,被氧气氧化为二氧化氮,二氧化氮通入溶液中生成硝酸,Cu与稀硝酸反应生成硝酸铜和NO、水,其反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;酸性条件下,硝酸根离子和Cu能反应,所以向溶液中加硫酸,硝酸根离子与Cu继续反应;
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;D;
(5)水和过氧化钠反应生成氢氧化钠和氧气,二氧化碳和过氧化钠反应生成碳酸钠和氧气,将B中固体混合物溶于500mL1mol•L-1 盐酸中,产生无色混合气体,溶液呈中性,所以溶液中的溶质是氯化钠,根据钠原子守恒计算过氧化钠的物质的量,
HCl~NaCl~$\frac{1}{2}$Na2O2
1 $\frac{1}{2}$
1mol•L-1×0.5L 0.25mol
所以过氧化钠的物质的量为0.25mol.
故答案为:0.25;
(6)二氧化氮和水反应,为防止倒吸可以在装置E、F之间增加一个防倒吸装置,铜和硝酸反应的产物一氧化氮以及生成的二氧化氮均有毒,应加一个尾气吸收装置,
故答案为:在装置E、F之间增加一个防倒吸装置;在装置F后增加一个尾气吸收装置.
点评 本题考查了探究物质性质实验的综合应用,题目难度较大,要求学生熟练掌握氨气的制法及化学性质,对学生的思维能力提出了较高的要求,充分考查了学生灵活应用所学知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
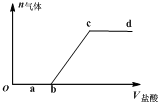 向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应溶液中:Ca2+、Mg2+、Br-、NO3- | |
| B. | b点对应溶液中:Al3+、Fe3+、MnO4-、NO3- | |
| C. | c点对应溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应溶液中:F-、NO3-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
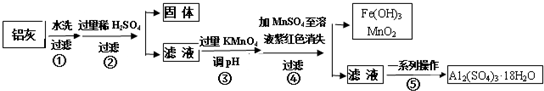
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
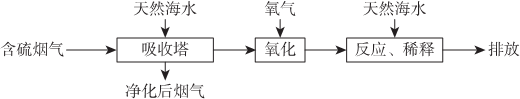
| A. | 天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解 | |
| B. | “氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀 | |
| D. | “排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com