
硫的化合物在工业上有广泛的应用,因此研究硫的化合物制备有着重要的意义.某同学拟采用下图装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5).已知装置图l—II中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5
(l)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为______________;如果想控制反应速度,图2中可选用的发生装置是_______(填写字母).
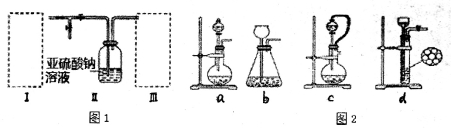
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是________________
(3)装置III用于处理尾气,可选用的最佳试剂是______________(填序号).
a、饱和食 盐水 b、NaOH溶液 c、浓硫酸 d、饱和NaHCO3溶液
盐水 b、NaOH溶液 c、浓硫酸 d、饱和NaHCO3溶液
(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为___________________
(5)工业制备得到产品Na2S2O5中含有杂质碳酸钠,检验产品中含有碳酸钠杂质所需试剂是___________(填编号)(已知Na2S2O5溶于水即生成NaHSO3)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年安徽省高二上期中文化学卷(解析版) 题型:选择题
下列反应属于氧化还原反应的是( )
A.Na2O+H2O==2NaOH
B.H2+CuO==Cu+H2O
C.CaCO3==CaO+CO2↑
D.KOH+HNO3==KNO3+H2O
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上第二阶段考化学试卷(解析版) 题型:选择题
向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是
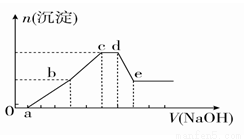
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
C.c点溶液中溶质只有NaCl
D.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO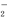 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:选择题
N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如 下,用
下,用 、
、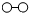 、
、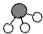 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是
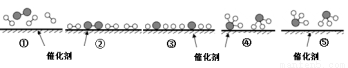
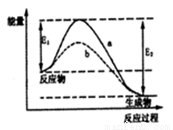
A.使用催化剂,合成氨反应放出的热量减少
B.在该过程中,N2、H2断键形成N原子和H原子
C.在该过程中,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:选择题
常温下,下列微粒能在相应溶液中大量共存的是
A.稀硫酸中:K+、MnO4-、CH3CH2OH
B.pH=11的溶液中:Na+、CO32-、NH3·H2O
C.中性溶液中:Na+、NO3-、AlO2-
D.FeCl3溶液中:H2O2、Mg2+、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:选择题
下列有关实验的操作正确的是( )
实验 | 操作 | |
A | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
B | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移除导管 |
C | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.Fe(NO3)3溶液中加入足量HI溶液:2Fe3++2I-=2Fe2++I2
B.用H2O2和H2SO4的混合溶液蚀刻铜:Cu+H2O2+2H+=Cu2++2H2O
C.NH4HCO3溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.C12通入NaOH溶液:Cl2+OH-=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
已知NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:选择题
设为阿伏加德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1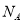
B.标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4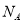
C.pH=13的NaOH溶液中含有的OH-为0.1mol
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4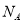
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com