
【题目】迄今为止,煤不但是人类使用的主要能源,也是重要的化工原料。如图是以煤为原料合成聚苯乙烯塑料的流程。
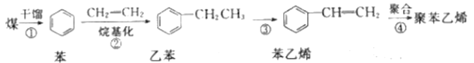
(1)苯在一定条件与Cl2反应可生成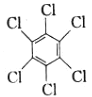 ,该反应类型为___(填“取代”或“加成”)反应;
,该反应类型为___(填“取代”或“加成”)反应;
(2)如图流程中原子利用率为100%的反应是___(填字母);
A.①③ B.②④
(3)能使酸性高锰酸钾溶液褪色的是___(填“![]() ”或“
”或“![]() ”)。
”)。
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法错误的是 ( )
A.In是第五周期第ⅢB族元素B.![]() In的中子数与电子数的差值为17
In的中子数与电子数的差值为17
C.原子半径:In>AlD.碱性:In(OH)3<RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。下列研究目的和图示相符的是
2NH3(g) ΔH<0。下列研究目的和图示相符的是
A | B | C | D | |
研究目的 | 温度(T)对反应的影响(T2>T1) | 压强(p)对平衡常数的影响 | 温度(T)对反应的影响 | 压强(p)对反应的影响(p2>p1) |
图示 |
|
|
|
|
A.AB.B .C.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(2) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为__________。
(3) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(4) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是
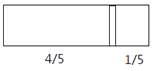
A.右边CO和CO2分子数之比为1:3
B.右边CO的质量为14g
C.右边气体密度是相同条件下氧气密度的2倍
D.若改变右边CO和CO2的充入量而使隔板处于距离右端1/3 处,若保持温度不变,则前后两次容器内的压强之比为5:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是( )
HCO3-+OH-。下列说法错误的是( )
A.加水稀释,溶液中所有离子的浓度都减小B.通入CO2,溶液pH减小
C.加入NaOH固体,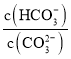 减小D.升高温度,平衡常数增大
减小D.升高温度,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-Q1
②H2(g)+![]() O2(g)=H2O(g) ΔH2=-Q2
O2(g)=H2O(g) ΔH2=-Q2
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-Q3
O2(g)=H2O(l) ΔH3=-Q3
常温下取体积比为4:1的甲烷和氢气共11.2L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为( )
A.0.4Q1+0.05Q2B.0.4Q1+0.1Q2
C.0.4Q1+0.1Q3D.0.4Q1+0.05Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物中,无论以何种比例混合,只要二者的物质的量之和不变,完全燃烧时消耗的氧气及生成的水的物质的量也不变的是
A.C2H2和C6H6
B.C2H6和C2H5OH
C.C2H4和C2H6O
D.C6H6和C7H6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-的电子式可表示为_____;1mol C22-中含有的![]() 键数目为________。
键数目为________。
(2)将乙炔通入[Cu(NH3)2Cl]溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为___。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是________;分子中处于同一直线上的原子数目最多为___________。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com