
【题目】新型高效的甲烷燃料电池两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组进行如下的实验,根据装置图回答下列问题:
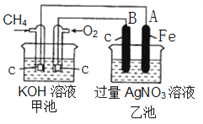
(1)通入CH4的电极的电极反应式是__________ ,A的电极反应式是______________ 。
(2)通电一段时间后,乙池中溶液的pH_________(填“升高”“降低”或“不变”),当乙池中某一电极质量增加 10.8g时,电路中有______ mol电子通过,理论上甲池中共消耗气体 _________mL(标准状况下)。
【答案】 CH4+10OH--8e-=CO32-+7H2O Ag++e-=Ag 降低 0.1 840
【解析】(1)甲烷在反应中失去电子,则通入CH4的电极是负极,电解质是氢氧化钾,则电极反应式是CH4+10OH--8e-=CO32-+7H2O,A电极与电源负极相连,则A电极是阴极,银离子放电,电极反应式是Ag++e-=Ag。(2)B电极是阳极,氢氧根放电,通电一段时间后,乙池产生硝酸,溶液的pH降低,当乙池中某一电极质量增加10.8g即析出银的质量是10.8g,物质的量是0.1mol,所以电路中有0.1mol电子通过,根据电荷守恒可知消耗氧气是0.1mo÷4=0.025mol,消耗甲烷是0.1mol÷8=0.0125mol,所以理论上甲池中共消耗气体(0.025mol+0.0125mol)×22.4L/mol=0.84L=840mL(标准状况下)。


科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,则H3PO2(aq)中离子浓度的顺序为:__________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银
①H3PO2中,磷元素的化合价为_____
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___(填化学式);
③NaHPO2为____(填“正盐”或“酸式盐”),其溶液显_____(“弱酸性”,“中性”或“弱碱性”).
(3)H3PO2的工业制法是将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H3PO2),后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子,阴离子通过):
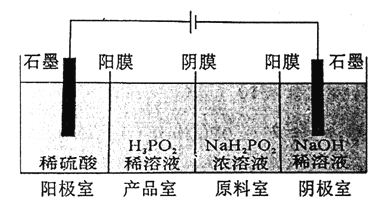
①写出阳极的电极反应式:___________②分析产品室可得到H3PO2的原因:__________
(5)磷酸(H3PO4) 在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
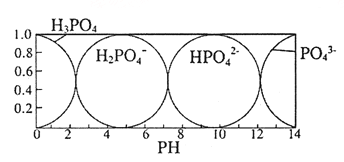
①向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为______。
②从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是_______。(填选项字母)
A、c(Na+) >c(H2PO4-) >c(H+) >c(HPO42-) >c(H3PO4)
B、c(Na+) >c(H2PO4-) >c(OH-)>c(H3PO4) >c(HPO42-)
C、c(H+)+ c(Na+)= c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+ c(H3PO4)
D、c(Na+)= c(H2PO4-)+c(HPO42-)+c(PO43-)+ c(H3PO4)
③假设在25℃时测得0.1 mol·L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=______mol·L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A-I之间的转化关系如图所示

已知A有下列性质:
I.苯环上只有个取代基;
II.核磁共振氢谱中有五组峰;
III.能使Br2的CC14溶液褪色,能与NaHCO3溶液反应放出气体。
请回答
(1)A中的无氧官能团的名称为__________________,③的反应条件为__________________________。
(2)H的分子式为____________________________。
(3)G为加聚产物则反应⑥的化学方程式为________________________________。
(4)写出C与过量的NaOH溶液反应的化学方程式___________________________。
(5)符合下列条件的F同分异构体有______种(不考虑立体异构),写出苯环上的一氯代物只有一种的结构简式_____________________。
a.不能发生水解反应
b.苯环上有两个取代基
c.1molF的同分异构与足量银氨溶液反应生成4molAg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答: ![]()
(1)写出元素符号:
A;B;C .
(2)C的原子结构示意图:;B的最高价氧化物对应水化物的化学式为 .
(3)A的氢化物的水溶液显(填“酸”或“碱”)性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钢铁的腐蚀的下列叙述中,正确的是( )
A.吸氧腐蚀时阴极放出氧气
B.析氢腐蚀时阴极放出氢气
C.化学腐蚀速率超过电化学腐蚀速率
D.析氢腐蚀比吸氧腐蚀普通
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。

(1)装置Ⅱ的试管中不装任何试剂,其作用是______________________________,试管浸泡在50 ℃的水浴中,目的是___________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
限选试剂:A.3 mol·L-1H2SO4、B.6 mol·L-1NaOH、C.0.5 mol·L-1BaCl2、D.0.5 mol·L-1Ba(NO3)2、E.0.01 mol·L-1酸性KMnO4溶液。(填所选试剂的序号)
检验试剂 | 预期现象和结论 |
装置Ⅲ的试管中加入________ | 产生大量白色沉淀,证明气体产物中含有SO3 |
装置Ⅳ的试管中加入________ | ____________________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是________。
(4) 配平离子方程式,并在![]() 中填上所需的微粒:_______________________
中填上所需的微粒:_______________________
H++ MnO4-+ Fe2+→ Mn2+ Fe3++ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铁制品上镀上一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有锌离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com