
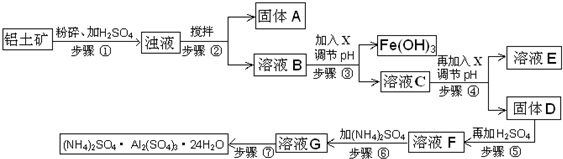
| 沉淀物 | Al(OH)3 | Fe (OH)3 | Mg (OH)2 |
| 开始沉淀pH | 3.8 | 2.7 | 9.4 |
| 完全沉淀pH | 5.2 | 3.2 | 12.4 |


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:
 意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知N-N键能167kJ?mol-1N≡N键能942kJ?mol-1.根据以上信息和数据,能判断且说法正确的是( )
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知N-N键能167kJ?mol-1N≡N键能942kJ?mol-1.根据以上信息和数据,能判断且说法正确的是( )| A、N4属于一种新型的化合物 |
| B、N4与N2互为同素异形体 |
| C、N4比P4(白磷)更稳定 |
| D、N4气体转变为N2将吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
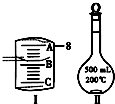 实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:
实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+的物质的量 |
| B、醋酸的电离常数 |
| C、中和时所需NaOH的量 |
| D、溶液的导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16 g |
| B、32 g |
| C、64 g?mol-1 |
| D、32 g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com