
| A. | 弱电解质的电离达到平衡状态后,电离就停止了 | |
| B. | 弱电解质的电离达到平衡状态后,分子的消耗速率和离子的生成速率相等 | |
| C. | 弱电解质的电离达到平衡状态后,分子和离子的浓度相等 | |
| D. | 弱电解质的电离达到平衡状态后,外界条件改变,电离平衡可能要发生移动 |
分析 弱电解质电离达到平衡状态时,电解质的电离速率与离子结合生成电解质的速率相等,达到动态平衡状态,反应体系中各微粒的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.电解质电离达到平衡状态后,电解质的电离速率与离子结合生成电解质的速率相等,达到动态平衡状态,故A错误;
B.无论是否达到平衡状态,都存在分子的消耗速率和离子的生成速率相等,故B错误;
C.弱电解质的电离达到平衡状态后,分子和离子的浓度都不变,但不一定相等,故C错误;
D.弱电解质的电离达到平衡状态后,正逆反应速率相等,反应为动态平衡状态,但外界条件改变,电离平衡可能被打破,所以可能要发生移动,从新达到新的平衡状态,故D正确;
故选D.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点及电离平衡状态特征是解本题关键,侧重考查学生分析判断能力,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
| 实验序号 | 温度(℃) | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | X |
| 3 | 110 | 0.8 | Y | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子中C═C双键中有一个键容易断裂 | |
| B. | 乙烯分子中6个原子共平面 | |
| C. | 不能用酸性高锰酸钾溶液除去乙烷中混有的乙烯 | |
| D. | 乙烷和乙烯都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平均反应速度:乙>甲 | B. | 平衡时nc(甲)>nc(乙) | ||
| C. | 平衡时C的转化率:甲>乙 | D. | 平衡时A的物质的量甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| B. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| C. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| D. | 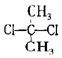 与 与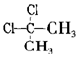 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 加入催化剂 | C. | .增大H2(g)的浓度 | D. | 增大NH3(g)的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂中必定有元素化合价升高被氧化 | |
| B. | 通电后,氢氧化铁胶体向阴极运动 | |
| C. | 物质所含元素化合价升高的反应叫还原反应 | |
| D. | 胶体与其他分散系的本质区别是可以发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
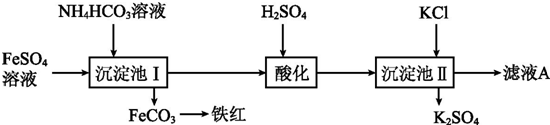
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com