
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
| A. | 对比实验①②可知,降低pH可以提高Cr2O72-的去除率 | |
| B. | 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O | |
| C. | 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-被还原 |
分析 A.对比实验①②,这两个实验中只有溶液酸性强弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72-的去除率越大;
B.实验②中,Cr2O72-在阴极上得电子发生还原反应;
C.实验③中,Cr2O72-在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72-;
D.实验③中,Cr2O72-在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72-,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-在阴极上被还原,且溶液中还有Cr2O72-被还原.
解答 解:A.对比实验①②,这两个实验中只有溶液酸性强弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72-的去除率越大,所以降低pH可以提高Cr2O72-的去除率,故A正确;
B.实验②中,Cr2O72-在阴极上得电子发生还原反应,电极反应式为Cr2O72-+6e-+14H+═2Cr3++7H2O,故B正确;
C.实验③中,Cr2O72-在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72-,离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,所以导致Cr2O72-去除率提高,故C正确;
D.实验③中,Cr2O72-在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72-,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-在阴极上被还原,且溶液中还有1molCr2O72-被Fe2+还原,所以一共有2 mol Cr2O72-被还原,故D错误;
故选D.
点评 本题考查电解原理,为高频考点,明确离子放电顺序及电解原理是解本题关键,注意:活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,易错选项是D.


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在12.0g NaHSO4晶体中,所含离子数目为0.3NA | |
| B. | 在1.0L 1.0mol/L的NaA1O2溶液中,含有的氧原子数为2NA | |
| C. | 将1molCl2通入足量水中,转移电子数为NA | |
| D. | 常温常压下,2.2gC O2和N2O的混合气体含有的电子数为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | |
| B. | 铅蓄电池放电时的负极和充电时的阳极均发生在原反应 | |
| C. | 水解NH4++H2O?NH3•H2O+H+反应达到平衡后,升高温度平衡逆向移动 | |
| D. | 等体积、等物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$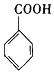
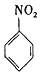 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧化)
(苯胺,易被氧化) .
. .
. .
. 最合理的方案(不超过3步).
最合理的方案(不超过3步). $→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
$→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 | |
| B. | ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 | |
| C. | ③中采用了牺牲阳极的阴极保护法保护桥墩 | |
| D. | ①②③中海水均是实现化学能与电能相互转化的电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
| ② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①③⑥⑦ | B. | ③④⑤⑥ | C. | ①②④⑤ | D. | ①⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH是只含离子键的离子化合物 | |
| B. | HCl溶于水没有破坏共价键 | |
| C. | 碳在O2中燃烧时,破坏碳和O2中化学键吸收的总能量大于形成CO2中化学键释放的总能量 | |
| D. | 在Cl2+2NaBr=2NaCl+Br2反应过程中有离子键和共价键的断裂,也有离子键和共价键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
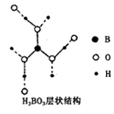 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )| A. | 含1 mol H3BO3的晶体中有6 mol氢键 | |
| B. | 分子中硼原子、氧原子最外层均为8e-的稳定结构 | |
| C. | 正硼酸晶体属于原子晶体 | |
| D. | H3BO3分子的稳定性与氢键无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com