
100mL 1 mol/LAl2(SO4)3溶液中,Al3+物质的量浓度是 ,含Al3+物质的量 mol,从其中取10ml,Al2(SO4)3物质的量浓度是 ,再将这10ml溶液稀释成100ml,物质的量浓度又为 。Al3+与SO42-物质的量浓度之比是 。
科目:高中化学 来源:2014-2015学年福建省高一上学期第二次阶段测试化学试卷(解析版) 题型:选择题
下列关于纯净物、混合物、电解质和非电解质的正确组合是
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 盐酸 | 泥水 | 食盐 | 氨水 |
B | 苛性钾 | 碘酒 | 醋酸 | 干冰 |
C | 石油 | 石灰石 | 磷酸 | 水 |
D | 苏打 | 天然气 | 二氧化硫 | 酒精 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:填空题
(1)(10分)在①蛋白质 ②油脂 ③葡萄糖 ④纤维素⑤淀粉五种物质中,不能水解的是______(填序号),在人体中不能直接被消化吸收的是 (填序号),蛋白质水解后最终生成 (填名称),油脂水解后得到醇的结构简式是 。
(2)某学生设计用如下实验方案用以检验淀粉水解的情况:
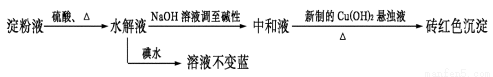
由水解液分别进行上述实验后的现象,可得出的实验结论应该是 (填序号)。
A.淀粉尚有部分未水解
B.淀粉已完全水解
C.淀粉没有水解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:选择题
为了改善食品色、香、味,我们在食物中加入某些食品添加剂。下列食品添加剂的使用不合理的是
A.在烹饪食物时,加入适量食盐
B.在饮料制作中,为了更美观,常加入大量的天然色素
C.在烹饪鱼类食物时,加入适量食醋
D.为了补充营养物质,食品中加入少量维生素
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:填空题
写出下列反应的离子方程式。
(1)用稀硫酸清洗铁锈(Fe2O3)_____________________________________
(2)碳酸钠溶液与盐酸混合___________________________________________
(3)硫酸铜溶液和氢氧化钡溶液混合_____________________________
(4)向足量澄清石灰水中通入二氧化碳________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
某实验小组只领取下列仪器或用品:铁架台、铁圈、铁架、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、火柴、滤纸、漏斗。只应用上述仪器或用品,不能 进行的实验操作是
A.蒸发 B.萃取 C.过滤 D.蒸馏
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
在恒容密闭容器中发生反应2NO2  2NO+O2,下列所述可以说明反应达到平衡状态的是
2NO+O2,下列所述可以说明反应达到平衡状态的是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变
A.①③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:填空题
[化学一选修2:化学与技术](15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:

金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com