
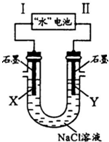
 研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )| A. | I为负极,其电极反应式为Ag+Cl-+e-=AgCl | |
| B. | “水”电池内Na+不断向负极作定向移动 | |
| C. | 每转移1 mol e-,U型管中消耗0.5 mol H2O | |
| D. | “水”电池内,每生成1 mol Na2Mn5O10,X电极上生成1 mol气体 |
分析 A.X电极上有无色气体逸出,应为阴极,生成氢气,则Ⅰ为负极,Ⅱ为正极,根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物;
B.原电池工作时,阳离子向正极移动;
C.根据2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,结合转移电子数计算;
D.方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,结合X电极反应计算.
解答 解:A.X电极上有无色气体逸出,应为阴极,生成氢气,则Ⅰ为负极,根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物,则负极发生Ag+Cl--e-=AgCl,故A错误;
B.原电池工作时,阳离子向正极移动,所以“水”电池内Na+不断向正极作定向移动,故B错误;
C.每转移1mole-,由2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,可知生成0.5mol氢气,消耗1mol水,故C错误;
D.方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,又X电极上有无色气体逸出,即电极反应为2H2O+2e-=2OH-+H2↑,所以X电极上生成1 mol气体,故D正确.
故选D.
点评 本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
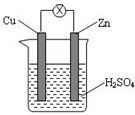
| A. | Zn 是负极,发生还原反应 | B. | Cu 是负极,发生氧化反应 | ||
| C. | Cu 片上有气体逸出 | D. | 电子由 Cu 片通过导线流向 Zn 片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>R>Z | |
| B. | W的气态氢化物的热稳定性比Y的强 | |
| C. | Z与W形成的是离子化合物 | |
| D. | W的最高价氧化物对应水化物酸性比R的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中半径最小的元素,W与Y组成的化合物是温室气体、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中半径最小的元素,W与Y组成的化合物是温室气体、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com