
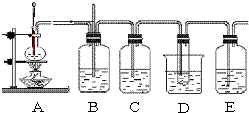
 如图是制取1,2-二溴乙烷的装置,根据信息回答问题:
如图是制取1,2-二溴乙烷的装置,根据信息回答问题:| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g?cm-3 | 难溶于水,易溶于醇、醚等 |
| 浓硫酸 |
| 170℃ |
| 加热 |
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
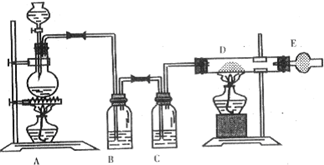
科目:高中化学 来源: 题型:

| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g?cm-3 | 难溶于水,易溶于醇、醚等 |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
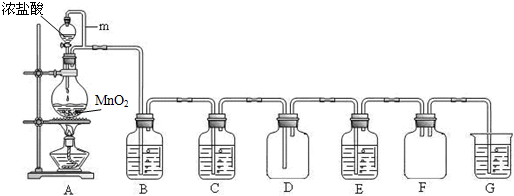
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省温州市十校联合体高一上学期期中联考化学试卷(解析版) 题型:实验题
如图是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:
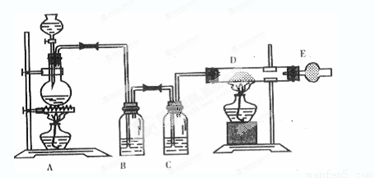
(1)盛放浓盐酸的仪器名称为____;
(2)烧瓶中发生反应的化学方程式 ;
(3)C瓶中的试剂是____;其作用是____;
(4)玻璃管D中发生反应的化学方程式 ;反应现象是___;
(5)干燥管E中盛有碱石灰(CaO+NaOH),其作用是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com