
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
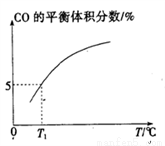
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
25℃时,部分弱酸的电离平衡常数如表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10﹣5 | 4.9×10﹣10 | K1=4.3×10﹣7 K2=5.6×10﹣11 |
下列有关说法正确的是( )
A. 等物质的量浓度溶液的pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. a mol•L﹣1HCN溶液与b mol•L﹣1NaOH溶液等体积混合后,所得溶液中:c(Na+)>c(CN﹣),则a一定小于b
C. 往冰醋酸中逐滴加水,溶液的导电性逐渐增大
D. 将0.2 mol•L﹣1 KHCO3溶液与0.1 mol•L﹣1 KOH溶液等体积混合:c(K+)+c(H+)=c(OH﹣)+c(HCO3-)+2c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如下图所示。下列关于固体

燃料电池的有关说法中正确的是
A. 固体氧化物的作用是让电子在电池内通过
B. 固体氧化物中O2-从a极向b极移动
C. 电极b为电池的负极,电极反应式为:O2 + 4e- = 2O2-
D. 若以C3H8为燃料气,则接触面上发生的反应为C3H8 – 20e- + 10O2- =3CO2 +4H2O
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:简答题
元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、 [Cu(NH3)4]2+(深蓝色)等形式存在。CuCl为难溶于水的白色固体。回答下列问题:
(1)在浓的强碱溶液中,Cu2+与Al3+的化学性质相似。在少量的CuSO4溶液中,逐渐加入浓的NaOH溶液直至过量,可观察到的现象是_____________________。
(2)CuCl溶于浓盐酸时发生的反应为CuCl+HCl H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
(3)[Cu(H2O)4]2+和[Cu(NH3)4]2+在溶液中可以相互转化。:t℃时,初始浓度为1mol•L-1的CuSO4溶液中{ Cu2+实际以[Cu(H2O)4]2+的形式存在},[Cu(NH3)4]2+的浓度随氨水浓度[c(NH3)]的变化如图所示
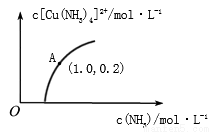
①CuSO4溶液与过量氨水发生反应的总的离子方程式为________________。
②由图可知,溶液的酸性增大,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率___________(填“增大”“减小”或“不变”)。根据A点数据,计算出该温度下的平衡常数K=__________。
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,则该反应的ΔH_____(填“>”“<”或“=”)0
④硫酸四氯合铜{[Cu(NH3)4]SO4}在碱性镀铜工艺中常用作电镀液的主要成分,电镀时,要控制局部温度不得高于150℃,可能的原因是_______________。电解时。阴极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法正确的是
A. 可以用新制的氢氧化铜悬浊液(可加热)鉴别乙醇、乙酸和葡萄糖溶液
B. 不含其他杂质的天然油脂属于纯净物
C. 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同
D. 苯和乙烯都能使溴水褪色,但两者发生的化学反应类型不同
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
有机物M、N、Q之间的转化关系为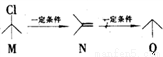 ,下列说法正确的是
,下列说法正确的是
A. M的同分异构体有3种(不考虑立体异构)
B. N分子中所有原子共平面
C. Q的名称为异丙烷
D. M、N、Q均能与Br2反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:简答题
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
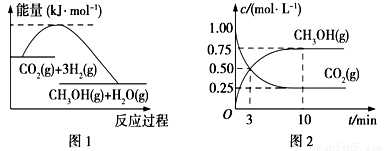
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________;
②下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度B.将CH3OH(g)及时液化抽出C.选择高效催化剂D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是:______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:简答题
氧化锌、氮化镓及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
Zn2+基态核外电子排布式为______________,其核外存在______________对自旋相反的电子。
写出两个与水分子具有相同空间构型的分子和阴离子:__________,____________。
水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________(填序号)。
A、氧原子的杂化类型发生了改变 B、微粒的空间构型发生了改变
C、微粒的化学性质发生了改变 D、微粒中的键角发生了改变
在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图甲),已知冰的升华热是+51kJ mol-1,除氢键外,水分子间还存在范德华力(11kJ
mol-1,除氢键外,水分子间还存在范德华力(11kJ mol-1),则冰晶体中氢键的键能是___________kJ
mol-1),则冰晶体中氢键的键能是___________kJ mol-1。
mol-1。
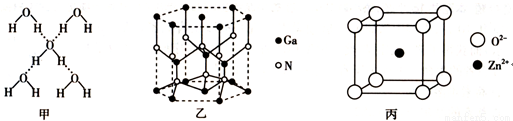
氮化镓的晶体结构如图乙所示,其中氮原子的杂化轨道类型是______________;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是______________;该晶体的化学式为______________。金刚砂(SiC)和氮化镓并称为第三代半导体材料的双雄,它与金刚石具有相似的晶体结构,试比较金刚石和金刚砂的熔点高低,并说明理由:__________________________。
某种ZnO晶体的晶胞如图丙所示,Zn2+的配位数为_______________,其晶胞中Zn2+和O2-之间的距离为apm,列式表示该晶体的密度:____________g cm-3(不必计算结果)。
cm-3(不必计算结果)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
能与Al反应生成H2的透明溶液中可能大量共存的一组离子是( )
A. K+、NO3-、AlO2-、Na+ B. NH4+、SO42-、CO32-、NO3-
C. Mg2+、Fe3+、Cl-、SCN- D. K+、Ca2+、Cl-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com