
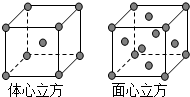
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
 ,
, ;
;| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
| A、乙酸钠溶液中加入少量盐酸:CH3COONa+H+-→CH3COOH+Na+ | |||
B、乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH
| |||
| C、苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→C6H5OH+2CO32- | |||
D、丙烯聚合:nCH2=CHCH3
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上的电子数相等;B是短周期中原子半径最大的元素;C元素的原子3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上的电子数相等;B是短周期中原子半径最大的元素;C元素的原子3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则c(Na+)=2c(ClO-)+c(HClO) |
| B、用NaOH 溶液吸收SO2 的过程中,当n(Na2SO3):n(NaHSO3)=1:1时(溶液pH=7.2),c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) |
| C、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) |
| D、用0.1000 mol/L NaOH 滴定 25.00 mL 0.1000 mol/L某一元酸HX,恰好完全反应时c(X-)+c(HX)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 (R-代表烃基)
(R-代表烃基)
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一.
如图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com