
| A、密闭低温是保存氨水的必要条件 |
| B、实验室常用排饱和食盐水的方法收集氯气 |
| C、铜与稀硝酸反应,开始反应缓慢后逐渐加快 |
| D、对于2SO2+O2?2SO3通入过量的空气来提高SO2转化率 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、18g | B、180g |
| C、198g | D、162g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl(HCl) |
| B、H2SO4(H2O) |
| C、AgNO3(HNO3) |
| D、CuSO4(CuCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②④⑤ |
| C、①②③④ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O+H2O=2NaOH |
| B、2F2+2H2O=4HF+O2 |
| C、Cl2+H2O=HCl+HClO |
| D、2K+2H2O=2KOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LCCl4含有的分子数为NA |
| B、标准状况下,3.2g氧气(O2)和臭氧(O3)中含有的分子总数为0.1NA |
| C、含4molHCl的浓盐酸与足量的MnO2反应,转移电子总数为2NA |
| D、常温下,78gNa2O2中含有的阴离子数是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫原子的原子结构示意图: | ||
B、H2O的电子式: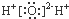 | ||
C、原子核内有10个中子的氧原子:
| ||
D、CO2的比例模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com