
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为FeS2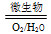 Fe2++SO42—
Fe2++SO42—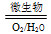 Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
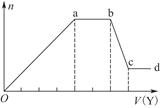
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、 、
、 、Cl-、I-、
、Cl-、I-、 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。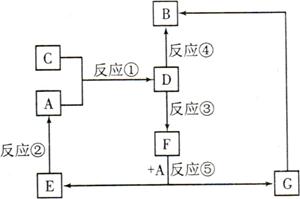
已知:
A为金属单质,B为红褐色固体,E为密度最小的气体,G为浅绿色的溶液。
D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)构成C物质的元素在周期表中的位置是 ,在短周期主族元素中,该元素与其相邻元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)D的水溶液呈 性,请用离子方程式解释原因: 。
(3)上述反应中属于置换反应的是 (填序号)。
(4)反应③(即D将某种氧化物氧化为F)的离子方程式: 。
(5)对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023个。请按照要求填空:
| 实验步骤 | 实验现象 | 写离子方程式 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 色 | |
| 继续通入气体 | 溶液逐渐变成无色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲由X、Z、Q三种元素组成,常温下0.1 mol/L甲溶液的pH=13。工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答下列问题: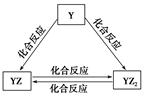
(1)Q的原子结构示意图为________。
(2)Y元素的单质能发生如图所示的转化,则Y元素为________(填元素符号)。
在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是__________________(用离子方程式和必要的文字说明)。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为______________________________________________________________________________;
②Q、W两种元素金属性的强弱为Q________W(填“<”或“>”),下列表述中能证明这一事实的是________(填序号)。
a.Q单质的熔点比W单质的低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c.W的原子序数大
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe3+的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | 氨水物质的量浓度/(mol·L-1) | 盐酸物质的量浓度/(mol·L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行如下实验:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | CO32—、SiO32—、AlO2—、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
 Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为分别得到各含一种金属阳离子的沉淀物。可采取①通入H2S气体,②通入CO2气体,③加入盐酸,④加入氢氧化钠溶液四个步骤,每次通入或加入试剂均过量,且每次都把沉淀物滤出,其操作的正确顺序是( )。
| A.③①④② | B.①③④② | C.④②①③ | D.④②③① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com