
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
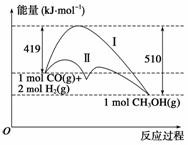
A.该反应的ΔH=91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
科目:高中化学 来源: 题型:
硫的卤化物(S2X2)是广泛用于橡胶工业的硫化剂,S2C12分子结构与H2O2相似。遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
A.稳定性S2C12>S2Br2
B.反应中,生成1molSO2,转移电子为3mol
C.分子中同时含有极性键和非极性键且各原子都满足8电子稳定结构
D.因为S-Cl键能比S-Br键能大,S2C12沸点比S2Br2高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+ O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+ O2(g)===H2O(l) ΔH5
O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaCO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④
C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)催化剂能改变反应的焓变 ( )
(2012·江苏,4B)
(2)催化剂能降低反应的活化能 ( )
(2012·江苏,4C)
(3)利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法( )
(2012·浙江理综,7A)
(4)化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律 ( )
(2011·浙江理综,7A)
(5)实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3 916 kJ·mol-1、
-3 747 kJ·mol-1和-3 265 kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键( )
(2011·浙江理综,12C)
(6)已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g)
ΔH=489.0 kJ·mol-1
CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1
则4Fe(s)+3O2(g)===2Fe2O3(s)
ΔH=-1 641.0 kJ·mol-1 ( )
(2011·浙江理综,12D)
(7)开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
( )
(2010·浙江理综,7B)
(8)500 ℃、300 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)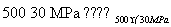 2NH3(g) ΔH=
2NH3(g) ΔH=
-38.6kJ·mol-1 ( )
(2010·浙江理综,12B)
(9)使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 ( )
(2009·浙江理综,7C)
(10)石油、煤、天然气、可燃冰、植物油都属于化石燃料 ( )
(2009·浙江理综,7D)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关焓变与反应热的说法,正确的是 ( )
A.反应热和焓变的单位都是kJ
B.如果反应是在恒温恒压条件下进行的,此时的反应热与焓变相等
C.如果反应是在恒温恒容条件下进行的,此时的反应热与焓变相等
D.任何化学反应的反应热均可通过实验直接测定
查看答案和解析>>
科目:高中化学 来源: 题型:
断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
| 化学键 | H—H | Cl—Cl | O===O | C—Cl | C—H | O—H | H—Cl |
| E/kJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=______________(用含有a、b的关系式表示)。
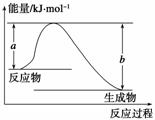
(2)若图示中表示反应H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b=________kJ·mol-1,x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b=________kJ·mol-1,x=__________。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧 气跟氯化氢反应制氯气。反应的化学方程式为___________________________。
气跟氯化氢反应制氯气。反应的化学方程式为___________________________。
若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电 子转移时,反应的能量变化为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com