
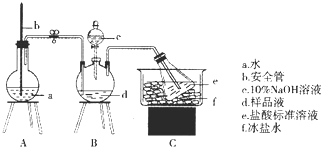
分析 (1)①通过b中液面调节A中压强;根据装置图可知,盛10% NaOH溶液仪器c的名称是分液漏斗;
②碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中;用酚酞做指示剂,滴定终点时溶液呈浅红色;
③根据氨气与和盐酸反应之间的关系式计算氨气的质量,再根据质量分数公式计算氨质量分数;若气密性不好,导致氨气的量偏低;
(2)根据离子积常数Ksp(Ag2CrO4)=c(CrO42-)•c2(Ag+)计算c(CrO42-);
(3)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,该反应中Co失电子、双氧水得电子,CoCl2•6H2O、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水;双氧水易分解、气体的溶解度随着温度的升高而降低.
解答 解:(1)①无论三颈瓶中压强过大或过小,都不会造成危险,若过大,A在导管内液面升高,将缓冲压力,若过小,外界空气通过导管进入烧瓶,也不会造成倒吸,安全管b的作用是使A中压强稳定,根据装置图可知,盛10% NaOH溶液仪器c的名称是分液漏斗,
故答案为:使A瓶中压强稳定;分液漏斗;
②碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中;用酚酞做指示剂,判断达到滴定终点时的现象为溶液变为浅红色,且30秒内不褪色,
故答案为:碱;溶液变为浅红色,且30秒内不褪色;
③与氨气反应的n(HCl)=V1×10-3L×C1mol•L-1-C2mol•L-1 ×V2×10-3L=(C1V1-C2V2)×10-3mol,根据氨气和HCl的关系式知,n(NH3)=n(HCl)=(C1V1-C2V2)×10-3mol,氨的质量分数=$\frac{({C}_{1}{V}_{1}-{C}_{2}{V}_{2})×1{0}^{-3}×17}{W}$×100%,若气密性不好,导致部分氨气泄漏,所以氨气质量分数偏低,
故答案为:$\frac{({C}_{1}{V}_{1}-{C}_{2}{V}_{2})×1{0}^{-3}×17}{W}$×100%;偏低;
(2)c(CrO42-)=$\frac{Ksp}{{c}^{2}(A{g}^{+})}$=$\frac{1.12×1{0}^{-12}}{(2.0×1{0}^{-5})}$mol/L=2.8×10-3 mol/L,
故答案为:2.8×10-3;
(3)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,该反应中Co失电子、双氧水得电子,CoCl2•6H2O、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水,反应方程式为2CoCl2+2NH4Cl+10NH3+H2O2$\frac{\underline{\;催化剂\;}}{\;}$2[Co(NH3)6]Cl3+2H2O;双氧水易分解、气体的溶解度随着温度的升高而降低,所以X的制备过程中温度不能过高,
故答案为:2CoCl2+2NH4Cl+10NH3+H2O2$\frac{\underline{\;催化剂\;}}{\;}$2[Co(NH3)6]Cl3+2H2O;温度越高过氧化氢分解、氨气逸出,都会造成测量结果不准确.
点评 本题考查了物质含量的测定,涉及难溶物的溶解平衡、氧化还原反应、物质含量的测定等知识点,明确实验原理是解本题关键,知道指示剂的选取方法,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中水电离出的c(H+)=10-8mol/L | |
| B. | 加水稀释,醋酸钠的水解程度增大,水的电离程度也增大 | |
| C. | 加入盐酸,pH=7时,有c(C1-)=c(CH3COOH) | |
| D. | 向溶液中加入醋酸呈酸性,则一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 逸項 | 实驗操作及现象 | 实验结论 |
| A | 向某溶洧液中同时滴加几滴KSCN溶液和少量的新制氯水,溶液变成血红色 | 该溶液中一定含有Fe3+ |
| B | 将澄清石灰水滴入可能混有Na2CO3的 NaHCO3溶液中出现白色沉淀 | 该液中一定含有Na2CO3 |
| C | 常温下,用pH计测定某溶液NaHSO3溶液的 pH约为5.20 | 该溶液中HSO3-的电离程度大于它的水解程度 |
| D | 常温下,向某溶液中滴加稀NaOH溶液将湿润的红石蕊试纸置于试管口,试纸不变蓝 | 该溶液中一定不含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
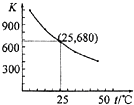 已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )
已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 利用该反应可以除去硫粉中少量的碘单质 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与12C互为同素异形体的14C可用于文物年代的鉴定 | |
| B. | 从海水中提取物质不一定都要通过化学反应实现 | |
| C. | 为避免核泄漏事故的危害,应推广燃煤发电,停建核电站 | |
| D. | 淀粉、油脂、蛋白质等都是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
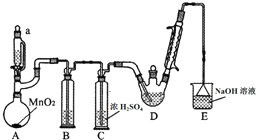 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
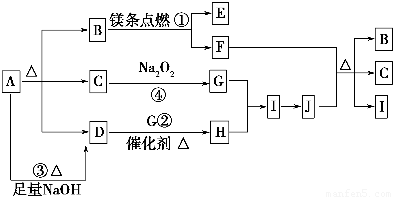
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| C. | Y与Z形成的化合物能与碱反应,但不能和任何酸反应 | |
| D. | X和Y,W和M均能形成原子个数比为1:1的分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com