
利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池。
(1)画出装置图(在图中标出电极材料、正负极、电解质溶液)。
(2)写出电极反应方程式
负极:
正极: (各2分)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?___________。简述你的理由(不需写出反应的方程式)__________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________________。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为_________。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O
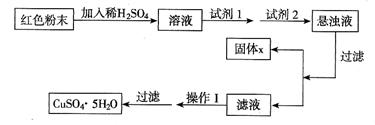
实验小组设计如下实验方案:

试回答:
①试剂1为___________,试剂2为___________(填字母)。
②固体X的化学式为________________________。
③操作Ⅰ为________________________。
查看答案和解析>>
科目:高中化学 来源:2010年浙江省瑞安中学高三上学期10月月考(化学) 题型:填空题
(14分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料
Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 。
(3)若固体粉末完全溶解无固体存在, 滴加 KSCN 试剂时溶液不变红色, 则证明原固体粉末是 ,写出所有发生的反应的离子方程式 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4 . 5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2 +、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源:2012届河北省石家庄市高三补充题、压轴题化学试卷(带解析) 题型:填空题
(14分)某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
Ⅰ: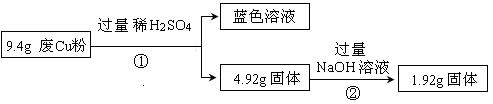
(1) 废Cu粉中一定含有的杂质是 。
(2) 分别写出过程①、②发生反应的离子方程式:
① ;
② 。
Ⅱ: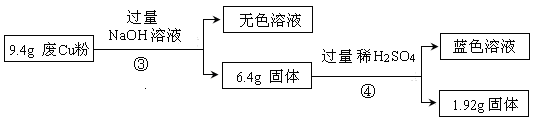
(3)综合过程Ⅰ、II,计算工业废Cu粉中各成分的质量之比是 (不必化简)。
Ⅲ:已知25℃时:
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
查看答案和解析>>
科目:高中化学 来源:2011届广东省清远市清城区高三第一次模拟考试(理综)化学部分 题型:实验题
已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某化学兴趣小组通过实验来探究某红色粉末是Fe2O3或Cu2O或两者的混合物。(实验所需试剂只能从下列中选择:稀硫酸、KSCN溶液、稀硝酸、双氧水、铁粉、碱式碳酸铜)
探究方案:将红色粉末溶于足量的稀硫酸中;实验现象:反应后有红色固体存在;
(1)结论:红色粉末是 。
(2)如果红色粉末是Cu2O和少量Fe2O3的混合物,请设计实验证明之。
实验操作:
实验现象:
(3)兴趣小组欲利用Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知:在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀的pH | 6.4 | 9.7 | 1.9 |
| 沉淀完全的pH | 9.6 | 12.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第9讲 金属及其化合物练习卷(解析版) 题型:实验题
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?________。简述你的理由(不需写出反应方程式)____________
________________________________________________________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是________,写出发生反应的离子方程式________________________________。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为________。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
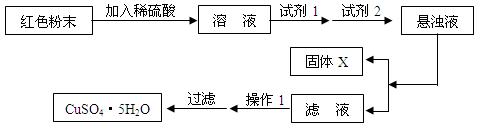
实验小组设计如下实验方案:

试回答:
①试剂1为________(填字母,后同),试剂2为________。
②固体X的化学式为____________________________________________________。
③操作Ⅰ为___________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com