
【题目】配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(1)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为________mL,如果实验室有15 mL、20 mL、50 mL 量筒,应最好选用________量筒。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是________
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②可以长期贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是________(填字母)。
A.①②③④ B.②③ C.①③④ D.②③④
(4)下面操作造成所配稀硫酸溶液浓度偏高的是 ________ (填序号)。
A.浓硫酸稀释后溶液没有冷却到室温就转移 B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶
E.用量筒量取浓硫酸时仰视刻度线
F.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
【答案】13.6 15 mL 500mL容量瓶、胶头滴管 C ACDE
【解析】
(1)由c=![]() 计算浓硫酸的物质的量浓度,结合溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积,依据浓硫酸体积选择合适规格的量筒;
计算浓硫酸的物质的量浓度,结合溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积,依据浓硫酸体积选择合适规格的量筒;
(2)配制一定物质的量浓度步骤计算、称量(量取)、溶解(稀释)、冷却、移液、洗涤、定容、摇匀、装瓶等,以此选择需要的仪器;
(3)容量瓶只能用于配制一定浓度的溶液,使用前需要查漏;
(4)由c=![]() 可知,不当操作使n偏大或V偏小,则所配溶液浓度偏高,以此来解答。
可知,不当操作使n偏大或V偏小,则所配溶液浓度偏高,以此来解答。
(1)质量分数98%、密度1.84g/cm3的浓硫酸的物质的量浓度c=![]() mol/L=18.4mol/L,配制0.5mol/L的硫酸溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积为V,则依据溶液稀释规律,18.4mol/L×V=0.5mol/L×500mL,解得V=13.6mL,应选择15mL量筒;
mol/L=18.4mol/L,配制0.5mol/L的硫酸溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积为V,则依据溶液稀释规律,18.4mol/L×V=0.5mol/L×500mL,解得V=13.6mL,应选择15mL量筒;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量(量取)、溶解(稀释)、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少的仪器:500mL容量瓶,胶头滴管;
(3)容量瓶是配制准确浓度溶液的仪器,不宜贮存溶液,不能用来加热,使用之前要检查是否漏水,故答案为C;
(4)A、浓硫酸稀释后溶液没有冷却到室温就转移,V偏小,则浓度偏高,故选;
B、转移时没有洗涤烧杯、玻璃棒,n偏小,则浓度偏低,故不选;
C、向容量瓶加水定容时眼睛俯视液面,V偏小,则浓度偏高,故选;
D、用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶,n偏大,则浓度偏高,故选;
E、用量筒量取浓硫酸时仰视刻度线,n偏大,则浓度偏高,故选;
F、摇匀后发现液面低于刻度线,又加蒸馏水至刻度线,V偏大,则浓度偏低,故不选。


科目:高中化学 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4=Cu+FeSO4
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4 =BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)反应①中,氧化剂是______________________。
(2)反应③的离子反应方程式为_________________________________________。
(3)写出一个符合⑧的化学反应方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液中,产物中可能含有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
A.参加反应的氯气的物质的量等于![]() a mol
a mol
B.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n(e-)的范围为![]() a mol≤n(e-)≤
a mol≤n(e-)≤![]() a mol
a mol
D.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组想制取CuO并证明CuO能加快KClO3的分解速率,设计并进行如下实验:
(一)制取CuO
①称取2 g胆矾研细后放入烧杯,加适量蒸馏水溶解;
②向步骤①所得溶液中逐滴加入NaOH溶液至铜离子沉淀完全;
③将步骤②所得沉淀过滤、洗涤,灼烧至恒重,研细备用。
回答下列问题:
(1)上述实验步骤中溶解、过滤时玻璃棒的作用依次是_____________。
(2)步骤③中灼烧前后,沉淀颜色的变化为_______。
(3)利用化学方法证明铜离子已经沉淀完全的操作是____________。
(二)证明CuO能加快KClO3的分解速率,并与MnO2的催化效率进行比较
用下图装置进行实验,且均以生成相同状况下20 mL氧气为准,其它可能影响实验的因素均已忽略,相关数据见下表:

实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
① | 1.5 g | 无其他物质 | |
② | 1.5 g | CuO 0.5 g | |
③ | 1.5 g | MnO2 0.5 g |
(4)上述实验中的待测数据指_____________;该实验除以上思路外,还可以通过测定______________来比较CuO和MnO2的催化效率。
(5)本实验装置图中量气装置由乳胶管和仪器A_______________(填名称)及50 mL___________(填“酸式”或“碱式”)滴定管改造后组装而成;
(6)为探究CuO在实验②中是否起催化作用,需补做如下实验:
a.CuO的质量有没有改变;
b.CuO的化学性质有没有改变。
简述验证CuO质量是否改变的操作过程_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4是一种精细化工产品,可用于治疗缺铁性贫血、制革、木材防腐等。制备步骤:①将3mol·L-1硫酸加入铁粉里,微热,搅拌使其充分反应;②趁热过滤;③在50℃左右蒸发、结晶,得到晶体——绿矾(FeSO4·7H2O)。回答下列问题:
(1)制备FeSO4溶液时一般不用较浓硫酸而用3mol·L-1硫酸的原因是___________,反应时要求铁粉过量的理由是__________。
(2)检验步骤①所得溶液中金属阳离子的方法是_________。
(3)步骤②趁热过滤的原因是__________。
(4)在空气中加热绿矾,固体质量与温度变化曲线如下图:
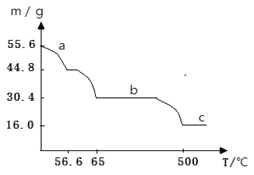
a曲线对应的反应化学方程式为____________。
c曲线对应的物质化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列各溶液中,下列有关说法正确的是
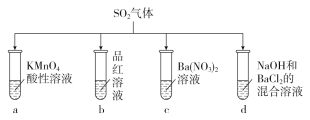
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,说明SO2具有还原性
D. 试管d中能产生白色沉淀,加入稀硝酸后沉淀完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素在化合物中其化合价可以呈现![]() 、
、![]() 价。
价。![]() 和
和![]() 是常见的
是常见的![]() 价铜的化合物,
价铜的化合物,![]() 是较为常见的
是较为常见的![]() 价铜的化合物。
价铜的化合物。
(1)铜元素位于周期表的_______区。
A、s B、p C、d D、ds E、f
(2)向![]() 溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较
溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较![]() 和
和![]() 中
中![]() 键角的大小:
键角的大小:![]() ___________
___________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)![]() 中阴离子的空间构型为_______,NO3-中的大π键应表示为______
中阴离子的空间构型为_______,NO3-中的大π键应表示为______
[信息:臭氧分子中,中心氧原子的未杂化的p轨道(含2个电子)与其它两个氧原子的p轨道(各含1个电子)肩并肩形成一个大π键,表示为![]() ,]
,]
![]() 的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
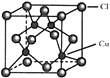
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②若以铜原子为顶点构成晶胞,面心原子为________(Cu、Cl)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com