
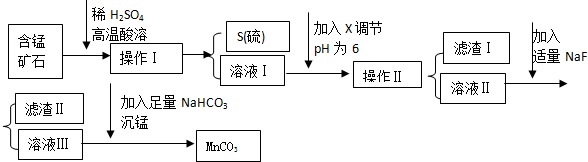
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Ca(OH)2 | 12 | ------ |
| Al(OH)3 | 3.8 | 4.7 |
分析 锰矿石的主要成分是MnO2还含CaO、Al2O3、FeS等杂质,加入稀硫酸高温酸溶,二氧化锰将氯化亚铁氧化成硫单质、铁离子,同时氧化钙和氧化铝与稀硫酸反应,通过操作Ⅰ过滤得到S沉淀和含有锰离子、铁离子、钙离子和铝离子的滤液Ⅰ;通过调节滤液Ⅰ的pH,将铝离子、铁离子转化成Al(OH)3、Fe(OH)3,过滤后分离出Al(OH)3、Fe(OH)3,滤液Ⅱ中含有钙离子和锰离子,加入NaF后将钙离子转化成CaF2沉淀,过滤后得到滤渣Ⅱ(CaF2沉淀)和滤液Ⅲ(主要含有硫酸锰),再加入碳酸氢钠,发生反应:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑,从而获得MnCO3,
(1)操作Ⅰ得到的是S单质的沉淀,据此判断分离方法;
(2)溶液Ⅰ加入KSCN溶液呈现红色,说明有铁离子存在,据此写出在酸溶过程中FeS发生反应的离子方程式;
(3)除杂时由于不能引进杂质,则调节溶液的pH所用的物质最好为MnCO3;
(4)根据表中数据分析可得到当pH=6的时候,铁离子和铝离子会完全沉淀,据此可知滤渣成分;滤液中还会含有钙离子,加入NaF后转化成CaF2沉淀;
(5)沉锰是利用碳酸氢钠与硫酸锰反应生成碳酸锰沉淀,据此写出反应的化学方程式;
(6)MnCO3也是制造锂离子电池的重要原料,在此电池充电过程中正极发生LiMn2O4失去电子写生成Li1-xMn2O4,据此写出该电池充电时正极发生的反应式.
解答 解:锰矿石的主要成分是MnO2还含CaO、Al2O3、FeS等杂质,加入稀硫酸高温酸溶,二氧化锰将氯化亚铁氧化成硫单质、铁离子,同时氧化钙和氧化铝与稀硫酸反应,通过操作Ⅰ过滤得到S沉淀和含有锰离子、铁离子、钙离子和铝离子的滤液Ⅰ;通过调节滤液Ⅰ的pH,将铝离子、铁离子转化成Al(OH)3、Fe(OH)3,过滤后分离出Al(OH)3、Fe(OH)3,滤液Ⅱ中含有钙离子和锰离子,加入NaF后将钙离子转化成CaF2沉淀,过滤后得到滤渣Ⅱ(CaF2沉淀)和滤液Ⅲ(主要含有硫酸锰),再加入碳酸氢钠,发生反应:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑,从而获得MnCO3,
(1)操作Ⅰ得到的是S单质的沉淀,该物质分离的方法为过滤,
故答案为:过滤;
(2)取溶液Ⅰ加入KSCN溶液,溶液呈现红色,说明有铁离子存在,所以在酸溶过程中FeS发生反应的离子方程式:FeS+12H++3MnO2$\frac{\underline{\;高温\;}}{\;}$2Fe3++2S↓+3Mn2++6H2O,
故答案为:FeS+12H++3MnO2$\frac{\underline{\;高温\;}}{\;}$2Fe3++2S↓+3Mn2++6H2O;
(3)由于不能引进杂质,则调节溶液的pH所用的物质X最好为MnCO3固体,故C正确,
故答案为:C;
(4)根据表中数据分析可得到当pH=6的时候,铁离子和铝离子会完全沉淀,因此滤渣为Al(OH)3、Fe(OH)3;
滤液中还会含有钙离子,则加入NaF后转化成CaF2沉淀,
故答案为:Al(OH)3、Fe(OH)3;CaF2;
(5)滤液Ⅲ中含有硫酸锰,硫酸锰与碳酸氢钠溶液反应生成碳酸锰沉淀、硫酸钠、二氧化碳和水,反应的化学方程式为:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑,
故答案为:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑;
(6)MnCO3也是制造锂离子电池的重要原料,在此电池充电过程中正极发生LiMn2O4失去电子的氧化反应,该电池充电时正极发生的反应式为:LiMn2O4-xe-=Li1-xMn2O4+xLi+,
故答案为:LiMn2O4-xe-=Li1-xMn2O4+xLi+.
点评 本题考查了制备方案的设计,题目难度中等,根据制备流程明确实验目的、制备原理为解答关键,注意掌握化学实验基本操作方法,试题有利于提高学生的分析、理解能力及化学实验能力.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢化物的通式为 RH5 | B. | 最高化合价是+5 价 | ||
| C. | 非金属性由上到下递增 | D. | 其最高价含氧酸均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | B. | NH4HCO3含有氮元素,可用作氮肥 | ||
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | D. | Al2O3硬度大,可用作耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2 | |
| B. | 氧化铜与硫酸反应:O2-+2 H+═H2O | |
| C. | 硫酸钠和氯化钡两种溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 盐酸与石灰石反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时含有分子和离子的电解质溶液,一定是弱电解质溶液 | |
| B. | pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 | |
| C. | 0.1 mol/L KOH溶液和0.1 mol/L 氨水中,其c(OH-)相等 | |
| D. | 室温时,pH=3的硫酸和pH=11的氨水等体积混合,混合溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com