
【题目】叠氮化钠(NaN3)与硝酸钾碰撞时发生的反应为: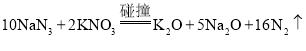 。若有1 mol N2生成,则下列判断正确的是
。若有1 mol N2生成,则下列判断正确的是
A.生成N2的体积一定为22.4 LB.有0. 125 mol KNO3被氧化
C.Na2O为氧化产物,N2为还原产物D.转移电子的物质的量为0.625 mol
科目:高中化学 来源: 题型:
【题目】中医药是中华民族的瑰宝,厚朴酚是一种常见中药的主要成分之一,有抗菌、消炎等功效,其结构简式如图a所示。下列说法错误的是( )
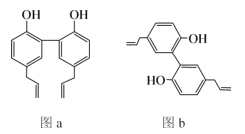
A.厚朴酚与溴可发生加成反应或取代反应
B.图b所示为厚朴酚的一种同分异构体
C.厚朴酚分子中所有碳原子可能共平面
D.1mol厚朴酚最多可跟8molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,在元素周期表中的位置如图所示,其中W元素的原子序数为Z元素原子序数的两倍,则下列说法正确的是
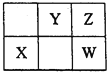
A. X位于元素周期表中的第3周期第ⅥA族
B. X、Y、Z三种元素对应原子的半径依次减小
C. XZ2和YZ2的结构和化学性质相似
D. 利用Y的含氧酸酸性强于W的含氧酸酸性,可证明非金属性W强于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的恒容密闭容器中,通入4mol A和5mol B,发生反应:4A(g)+5B(g)=3C(g)+3D(s)。5min后压强变为原来的80%,则该反应在0~5min内的平均反应速率可表示为
A.v(A)=0.24 mol·L-1·min-1B.v(B)=0.15 mol·L-1·min-1
C.v(C)=0.18 mol·L-1·min-1D.v(D)=0.36 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积的下列气体:①NO2,②HC1,③NH3。现将3支试管均倒置于水槽中,充分溶解后,所得溶液的物质的量浓度大小关系正确的是
A.①>②>③B.①=②=③C.②=③>①D.③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(主要成分为Cu、Zn)制备CuSO4·5H2O的部分实验步骤如图:
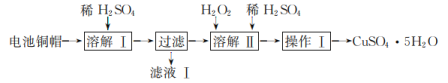
下列说法错误的是( )
A.“溶解I”中,为加快溶解速率,可将铜帽粉碎
B.“滤液I”中,溶质的主要成分为ZnSO4
C.“溶解II”过程中,有大量的气体产生
D.“操作I”需要用到酒精灯玻璃棒等仪器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
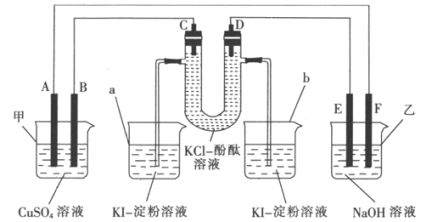
(1)判断装置的名称:甲池为_________(填“电解池”或“原电池”,下同),乙池为_________。
(2)B极为_________ (填“正极”或“负极”或“阳极”或“阴极”,下同),电极反应式为_________;F极为_________,电极反应式为__________________。
(3)U形管中溶液先变红的是_________(填“C”或“D”)极,U形管中发生反应的化学方程式为________________________________________。
(4)当烧杯中有38.1 g I2(KI足量)生成时,甲池中溶液的质量会减少________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活应用实例中,涉及氧化还原反应的是
A. 用白醋去除水垢
B. 用热的纯碱溶液清洗油污
C. 用风油精(含石蜡油)清洗透明胶残胶
D. 补铁剂(有效成分为Fe2+)与含维生素C共服效果更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请运用化学反应原理的相关知识回答下列问题:
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为_________________。该反应的△S ________0(选填“>”、“<”或“=”),该反应在_______条件下能自发进行(选填“高温”、“低温”或“任意温度”)。
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =____________。
②工业上高炉炼铁反应的平衡常数表达式K =______,温度升高后,K值_______(选填“增大”、“不变”或“减小”)。
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
下列说法正确的是____________(填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)请解释打开饮料“雪碧”的瓶盖,会有大量气泡冒出的原因:_____________.
(4)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。正极加入的物质是______;负极的电极反应是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com