
 向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y(mol)与试剂体积x(mL)间的关系曲线如图所示.试回答:
向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y(mol)与试剂体积x(mL)间的关系曲线如图所示.试回答:分析 (1)氢氧化铝可以溶解于氢氧化钠中,但是氢氧化镁不会溶解;偏铝酸钠可以和盐酸之间反应生成氢氧化铝;
(2)偏铝酸钠中通入二氧化碳会发生反应生成碳酸钠、氢氧化铝沉淀,据此书写反应;
(3)根据产生沉淀的量的变化以及沉淀的溶解情况确定先后滴加的试剂;
(4)氯化镁中氯离子物质的量是氯化镁物质的量的2倍,氯化铝中,氯离子物质的量是氯化铝物质的量的3倍,根据沉淀的量结合元素守恒来回答.
解答 解:(1)加入的试剂能立即产生沉淀,并且沉淀的量达到最大,然后沉淀溶解,根据氢氧化铝可以溶解于氢氧化钠中,但是氢氧化镁不会溶解;偏铝酸钠可以和盐酸之间反应生成氢氧化铝的性质,确定AB段所表示的反应的离子方程式是:Al(OH)3+OH-═AlO2-+2H2O,CD段所表示的反应的离子方程式是:AlO2-+H++H2O═Al(OH)3↓,故答案为:Al(OH)3+OH-═AlO2-+2H2O;AlO2-+H++H2O═Al(OH)3↓;
(2)沉淀量达到最小后,氢氧化铝全部转化为偏铝酸钠,通入二氧化碳会发生反应:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(3)加入的试剂能立即产生沉淀,并且沉淀的量达到最大,然后沉淀溶解,根据氢氧化铝可以溶解于氢氧化钠中,但是氢氧化镁不会溶解;偏铝酸钠可以和盐酸之间反应生成氢氧化铝的性质,确定a是NaOH,b是HCl,根据图象,结合图象消耗的酸碱体积的完全的对称的特点,根据反应实质:NaOH~Al(OH)3~AlO2-~H+,得到:盐酸和氢氧化钠的浓度之比是1:1,故答案为:NaOH;盐酸;1:1;
(4)原混合液中,加入氢氧化钠产生的氢氧化铝和氢氧化镁的物质的量是相等的,根据元素守恒,所以氯化镁和氯化铝的物质的量是相等的,氯化镁中氯离子物质的量是氯化镁物质的量的2倍,氯化铝中,氯离子物质的量是氯化铝物质的量的3倍,所以c(Al3+):c(Mg2+):c(Cl-)=1:1:5,故答案为:1:1:5.
点评 本题考查了镁、铝重要化合物的性质、根据化学式的计算等知识,题目难度较大,能正确分析图象中转折线发生的化学反应是解本题的关键,试题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇不能发生取代反应 | B. | C4H10(丁烷)有三种同分异构体 | ||
| C. | 氨基酸、淀粉均属于高分子化合物 | D. | 油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
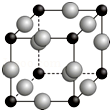 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液:2c(R2-)+c(HR-)=c(Na+) | |
| B. | 若将CO2通入0.1mol•L-1 Na2CO3溶液中至溶液中性,则溶液中c(H+)-c(CO32-)=c(OH-)-c(H2CO3) | |
| C. | 将c mol•L-1 的醋酸溶液与0.02mol•L-1 NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示醋酸的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| D. | 物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打不仅可用于治疗胃病,还可作灭火剂 | |
| B. | 用酸洗灼烧后的铂丝蘸取样品灼烧,火焰呈紫色,说明该样品中含钾元素 | |
| C. | 纯铁的熔点比生铁的低 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4使蔗糖炭化变黑,体现了浓H2SO4的氧化性 | |
| B. | 浓H2SO4使蓝色胆矾变成白色,体现了浓H2SO4的脱水性 | |
| C. | 浓H2SO4滴在润湿的蓝色石蕊试纸,试纸先变红,然后褪色,最后变黑,说明浓H2SO4具有酸性、氧化性和脱水性 | |
| D. | 100 mL 18 mol/L的浓H2SO4中加入足量的Cu并加热,被还原的H2SO4的物质的量为0.9 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com