
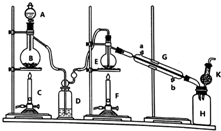
 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
分析 用Sn和氯气反应制取SnCl4,则A装置是制取氯气,需要浓盐酸和MnO2加热制取,浓盐酸具有挥发性,加热促进其挥发,所以生成的氯气中含有HCl,无水四氯化锡(SnCl4)易挥发形成气体,极易发生水解,为防止生成的四氯化锡发生水解反应,则用D装置干燥氯气,在E装置中氯气和Sn发生反应生成SnCl4,因为氯气中含有HCl,所以E中还生成SnCl2,采用蒸馏的方法分离SnCl4和SnCl2,用G装置冷却,在H中得到SnCl4,为防止H中SnCl4水解,K起干燥空气作用,据此分析解答.
(l)浓盐酸和二氧化锰发生氧化还原反应生成二氯化锰、氯气、水;
(2)四氯化锡极易发生水解,D装置干燥氯气;
(3)根据冷却水采用逆流方式分析;
(4)除去氯气中的氯化氢,用饱和食盐水的洗气瓶;
(5)防止H中SnCl4水解,K起干燥空气作用;
(6)为保证分离SnCl4和SnCl2的效果,需先停止反应再停止冷却;
(7)根据信息Sn也可与HCl反应生成SnCl2分析;
(8)根据氯原子守恒结合浓盐酸和MnO2的反应计算,为了避免尾气污染,需进行尾气处理.
解答 解:(1)A中在加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)D装置是干燥气体,防止生成的生成的四氯化锡发生水解反应,用浓硫酸干燥氯气,
故答案为:浓硫酸;除去H2O;
(3)G在冷却水采用逆流方式,所以下口为进水口、上口为出水口,即b为进水口,a为出水口,
故答案为:b;
(4)浓盐酸和MnO2加热制取,浓盐酸具有挥发性,加热促进其挥发,所以生成的氯气中含有HCl,E中还生成SnCl2,氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,即BD间增加盛饱和食盐水的洗气瓶,
故答案为:BD间增加盛饱和食盐水的洗气瓶;
(5)无水四氯化锡(SnCl4)易挥发形成气体,极易发生水解,为防止H中SnCl4水解,K起干燥空气作用,
故答案为:防止空气中水分进入;
(6)在E装置中氯气和Sn发生反应生成SnCl4,因为氯气中含有HCl,所以E中还生成SnCl2,采用蒸馏的方法分离SnCl4和SnCl2,用G装置冷却,当要结束实验时,需先停止F的加热,再停止G的通水,
故答案为:③;
(7)题干信息Sn也可与HCl反应生成SnCl2,若将B中的固体换成Sn,Sn与HCl反应生成SnCl2和氢气,可制备SnCl2,
故答案为:Sn;
(8)SnCl4为13.05g的物质的量为$\frac{13.05g}{261g/mol}$=0.05mol,需n(Cl)=0.05mol×4=0.2mol,需n(Cl2)=0.2mol×$\frac{1}{2}$=0.1mol,制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,所以需质量为:0.1mol×87g/mol=8.7g,为了避免尾气污染,需要改进的措施是在K后面加尾气吸收装置,
故答案为:8.70;在K后面加尾气吸收装置.
点评 本题考查物质制备,为高频考点,侧重考查学生分析判断及实验操作能力,明确实验目的及实验原理是解本题关键,注意结合题给信息进行分析解答,易错点是冷却水位置判断,知道各个仪器作用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 放热反应在任何条件都能自发进行 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| 1 | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| 2 | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| 3 | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| A. | 实验1和实验2可以探究Na2S2O3浓度对反应速率的影响 | |
| B. | 实验1和实验3可以探究温度对反应速率的影响 | |
| C. | 通过测定单位时间内收集到气体的体积判断化学反应速率快慢 | |
| D. | 实验3时,应先分别将Na2S2O3溶液、H2SO4溶液和水置于热水浴中加热到所需温度再混合发生反应,记录反应所需时间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,l.6gCH4中含有共价键总数为0.4NA | |
| B. | 常温常压下,2.24 L NO2气体中含有NO2分子数为0.1NA | |
| C. | 1 L0.lmol•L-1的醋酸中含有H十离子数为0.1NA | |
| D. | 铝热反应中1 molFe3O4完全反应,转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者是混合物,后者是纯净物 | |
| B. | 两者都具有丁达尔效应 | |
| C. | 分散质的粒子直径均在1~100nm之间 | |
| D. | 前者可用于杀菌,后者可用于净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答:
A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 16 | C. | 24 | D. | 32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com