
常温下在下列给定条件的溶液中,一定能大量共存的离子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3—
B.加入铝粉生成H2的溶液:K+、Mg2+、SO42—、HCO3—
C.c(Fe3+)=0.1 mol·L-1的溶液:H+、Al3+、Cl-、SCN-
D.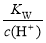 =0.1 mol·L-1的溶液:Na+、K+、SiO32—、NO3—
=0.1 mol·L-1的溶液:Na+、K+、SiO32—、NO3—
D
【解析】
试题分析:离子之间不发生化学反应,即为可大量共存:包括不生成沉淀、气体、弱电解质,不发生氧化还原反应、络合反应等,同时注意题目的附加条件。A、能使pH试纸呈红色的溶液为酸性溶液,大量存在H+,与溶液中的NO3—同时存在具有强氧化性,可与I-发生氧化还原反应,不可共存,错误;B、加入铝粉生成H2的溶液可能是酸性或者碱性溶液,若为碱性溶液,则与Mg2+不共存,若为酸性溶液,则与HCO3—不共存,错误;C、Fe3+与SCN-会发生络合反应,呈现血红色,不共存,错误;D.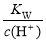 =0.1 mol·L-1=c(OH—),溶液PH==13,为碱性溶液,可共存,正确。
=0.1 mol·L-1=c(OH—),溶液PH==13,为碱性溶液,可共存,正确。
考点:考查离子共存


科目:高中化学 来源: 题型:
| A、非金属元素组成的化合物中可能含离子键 | B、ⅠA族金属元素是同周期中金属性最强的元素 | C、同种元素的原子均有相同的质子数 | D、ⅦA族元素的阴离子还原性越强,其氢化物越稳定 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:
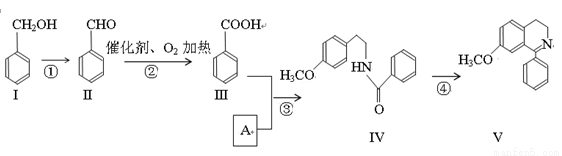
(1)Ⅱ中含氧官能团的名称 .
(2)反应②的化学方程式 。
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式 。
(4)下列说法正确的是 。
A. Ⅰ和Ⅴ均属于芳香烃 B. Ⅱ能发生银镜反应
C. Ⅱ能与4molH2发生加成反应 D. 反应③属于酯化反应
(5)A的结构简式 。
(6)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式 。
(7) 一定条件下,化合物Ⅶ(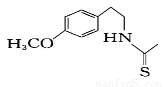 )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标况下,11.2L SO3所含的分子数目为0.5 NA
B.室温下,1L pH=1的稀硫酸溶液中,由水电离的H+离子数目为0.2NA
C.铅蓄电池放电时,正极消耗4mol H+,则电路中通过的电子数目为2NA
D.8 Al + 3NH4ClO4 =4 Al2O3 +3NH3 +3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA(Al原子量—27)
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
下列实验中,依据实验操作及现象得出的结论正确的是
| 操 作 | 现 象 | 结 论 |
A | 测定等浓度的Na2CO3和Na2SO3 溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
B | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
C | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32—或HCO3— |
D | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中可能含有Ag+ |
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:实验题
(16分)二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2 (g)+3H2(g)=CH3OH(l)+H2O(l) △H1 =-55.7 kJ/mol
②2CH3OH(l) = CH3OCH3(g)+H2O (l) △H2 =-23.4 kJ/mol
③CO2 (g)+3H2(g) =CO (g) + H2O (l) △H 3>0
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是___________________________________________________。
(2)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。下图是硅铝比与产物选择性图:
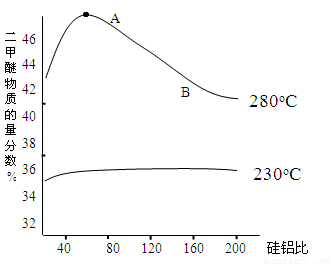
反应③的平衡常数表达式为 ,图中A点和B点的平衡常数比较:KA______KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律: ___________________。
(3)在280oC时,向一个2L的密闭容器中加入等量2mol二氧化碳和氢气, A点二甲醚的浓度为0.15 mol·L-1,计算在A点二氧化碳的转化率,要求写出计算过程。
(4)二甲醚逐渐发展为替代汽油的清洁燃料,在二甲醚燃料电池中,二甲醚通入______极,碱性条件下,该电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:填空题
(10分)汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1) 已知:N2(g) + O2(g) 2NO(g) ΔH1
2NO(g) ΔH1
N2(g) + 3H2(g) 2NH3(g) ΔH2
2NH3(g) ΔH2
2H2(g) + O2(g) 2H2O(g) ΔH3
2H2O(g) ΔH3
则4NO(g) + 4NH3(g) + O2(g) 4N2(g) + 6H2O(g) ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
4N2(g) + 6H2O(g) ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
(2) 在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
A.NO的生成速率与NO的消耗速率相等
B.v(CO)=v(CO2)
C.体系的压强保持不变
D.各物质的浓度保持不变
(3) 可用活性炭还原法处理氮氧化物。有关反应的化学方程式为:
C(s) + 2NO(g) N2(g) + CO2(g) ΔH >0
N2(g) + CO2(g) ΔH >0
某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
| NO | N2 | CO2 |
0
| 0.100
| 0
| 0
|
10
| 0.058
| 0.021
| 0.021
|
20
| 0.040
| 0.030
| 0.030
|
30
| 0.040
| 0.030
| 0.030
|
40
| 0.032
| 0.034
| 0.017
|
① 写出该反应的平衡常数表达式:K= 。
② 30 min后,改变某一条件,平衡发生了移动,则改变的条件是 ;若升高温度,NO浓度将 (填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
把氯气通入下列各物质的溶液中,阴离子和阳离子都能被氧化的是( )
A.NaOH B.Na2SO3 C.FeBr2 D.FeSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com