

分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(2)A.②金刚石、④晶体硅、⑥碳化硅是通过非极性键形成的原子晶体;②金刚石是熔点最高的晶体,C-Si键长小于Si-Si,熔点:碳化硅>晶体硅;
B.①干冰是直线型分子,属于分子晶体;③四氯化碳是正四面体型分子晶体;⑧氖是由单原子分子构成的分子晶体,四氯化碳的电子式为
C.⑤过氧化钠既含有离子键,又含有非极性共价键,其阳离子个数与阴离子个数之比为2:1.
解答 解:(1)①速率之比等于对应物质的化学计量数之比,反应开始后一直成立,不能说明反应达到平衡状态,故①错误;
②当体系达平衡状态时,反应混合物各组分的物质的量浓度不变,故②正确;
③该反应正方向为计量数减小的反应,随着反应进行压强不断减小,当压强不变时,反应达到平衡状态,故③正确;
④反应容器的体积不变,气体的质量守恒,所以密度始终不变,密度不变时不能说明反应达到平衡状态,故④错误;
⑤单位时间内生成n mol N2表示逆速率,生成3n mol H2表示逆速率,都表示逆速率,不能说明反应达到平衡状态,故⑤错误
⑥2V(N2正)=V(NH3逆),即氮气的正速率与氨气的逆速率之比等于计量数之比,则反应达到平衡状态,故⑥正确;
⑦单位时间内3molH-H键断裂等效于6mol N-H键形成,同时6mol N-H键断裂,故⑦错误;
⑧混合气体的物质的量逐渐减小,质量不变,则平均相对分子质量逐渐增大,当平均相对分子质量不变时,即是平衡状态,故⑧正确;
故答案为:②③⑥⑧;
(2)A.②金刚石、④晶体硅、⑥碳化硅是通过非极性键形成的原子晶体;②金刚石是熔点最高的晶体C-Si键长小于Si-Si,熔点:碳化硅>晶体硅;
故答案为:②④⑥;②⑥④;
B.①干冰是直线型分子,属于分子晶体;③四氯化碳是正四面体型分子晶体;⑧氖是由单原子分子构成的分子晶体四氯化碳的电子式为
故答案为:①③⑧;
C.⑤过氧化钠既含有离子键,又含有非极性共价键,其阳离子个数与阴离子个数之比为2:1,
故答案为:⑤;2:1.
点评 本题考查了化学平衡状态的判断、晶体的类型和化学键等,题目涉及的内容较多,侧重于考查学生对所学知识的综合应用能力,题目难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
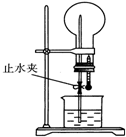 如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,然后打开止水夹.下列与实验事实不相符的是( )
如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,然后打开止水夹.下列与实验事实不相符的是( )| A. | Cl2(饱和食盐水) 无色喷泉 | B. | NH3(H2O含石蕊) 蓝色喷泉 | ||
| C. | HCl(H2O含石蕊) 红色喷泉 | D. | SO2(NaOH溶液) 无色喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙烯 | B. | 甲烷和丙烯 | C. | 乙烷和乙烯 | D. | 甲烷和丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 表中最稳定的共价键是H-F | B. | H2(g)=2H(g)需吸收436kJ的能量 | ||
| C. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | D. | 反应H2(g)+F2(g)=2HF(g)放出25kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
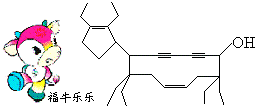
| A. | 牛式二烯炔醇含有4种官能团 | |
| B. | 牛式二烯炔醇不能使酸性KMnO4溶液褪色 | |
| C. | 1 mol牛式二烯炔醇最多可跟4mol Br2发生加成反应 | |
| D. | 该有机物的化学式为C29H44O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H的电子式为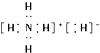 | |
| B. | 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数的数值) | |
| C. | NH4H中的H-半径比锂离子半径大 | |
| D. | NH4H晶体既有共价键又有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
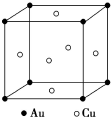 金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).
金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb为正极被氧化 | B. | SO42-只向PbO2处移动 | ||
| C. | Pb电极质量减少 | D. | 电解质溶液的pH不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液的导电性强弱是由浓度决定的 | |
| B. | 弱电解质和强电解质的导电,都是由带电离子的定向移动引起的 | |
| C. | 强电解质溶液导电能力强,弱电解质溶液导电能力弱 | |
| D. | 导电性强的溶液中的自由移动离子数目一定比导电性弱的溶液中的自由移动离子数目多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com