
【题目】三草酸合铁酸钾晶体(K3[Fe(C2O4)3]xH2O)(其中铁的化合价为+3价)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
Ⅰ.铁含量的测定
步骤1:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤2:取溶液25..00mL于锥形瓶中,酸化,滴加KMnO4溶液至草酸根(C2O42﹣)恰好全部被氧化成CO2,同时,MnO4﹣被还原成Mn2+;向反应后的溶液中加入锌粉至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+。
重复步骤2、步骤3操作,滴定消耗0.010mol/LKMnO4溶液19.98mL。
请回答下列问题:
(1)步骤2中加入锌粉至黄色刚好消失,目的是_____。
(2)写出步骤3中发生反应的离子方程式_____。
(3)根据实验数据,测得该晶体中铁元素的质量分数为_____。
(4)若步骤2中加入的KMnO4溶液的量不足,则测得的铁含量_____(选填“偏低”“偏高”或“不变”)
Ⅱ.结晶水的测定
(5)采用热重分析仪测定三草酸合铁酸钾晶体K3[Fe(C2O4)3]xH2O在110℃时的失重率为a%,则晶体
化学式中结晶水个数x的计算式为_____。(用含a的代数式表示)(已知:三草酸合铁酸钾的摩尔质量M(K3[Fe(C2O4)3])=437g/mol)
【答案】将Fe3+恰好还原成Fe2+ 5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O 11.2% 偏高 ![]()
【解析】
(1)锌粉具有还原性,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
(2)Fe2+被高锰酸钾溶液氧化成Fe3+;
(3)根据5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O,计算铁元素的质量分数;
(4)若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中会继续消耗酸性高锰酸钾;
(5)由失重率为a%可知,晶体中水的质量分数是a%。
(1)锌粉具有还原性,加入锌粉的目的是将Fe3+恰好还原成Fe2+,使得步骤三的反应得以进行并测定铁的含量;
(2)Fe2+被氧化成Fe3+,MnO4﹣被还原成Mn2,反应方程式为:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O;
(3)根据离子方程式计算,n(Fe)=5n(MnO4﹣)=5×![]() ×0.01 molL﹣1×10﹣3×10=1.0×10﹣2mol,m(Fe)=56 gmol﹣1×1.0×10﹣2mol=0.56g,晶体中铁的质量分数为:w(Fe)=
×0.01 molL﹣1×10﹣3×10=1.0×10﹣2mol,m(Fe)=56 gmol﹣1×1.0×10﹣2mol=0.56g,晶体中铁的质量分数为:w(Fe)=![]() ×100%=11.2%;
×100%=11.2%;
(4)若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高;
(5)由失重率为a%可知:![]() =a%,解得:x=
=a%,解得:x=![]() 。
。


科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
A. KClO3在反应中得到电子 B. ClO2是还原产物
C. H2C2O4发生氧化反应 D. 1 molKClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
(2)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是______________________。
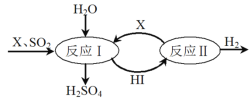
(3)SO2通过如图过程既能制得H2SO4又能制得H2。图中可循环利用的物质X是_________(填化学式),制得H2SO4的化学方程式是__________________________。
(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。所用烧碱溶液的物质的量浓度至少为________ mol·L1。若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.0g铜与60.0mL一定浓度的硝酸发生如下反应:Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O。铜完全溶解产生的混合气体体积为8.96L(标况)。请计算(各数据保留两位有效数字):
(1)NO的体积为______
(2)该混合气体的平均摩尔质量约为______
(3)待产生的气体全部释放后,向溶液加入100mL 2.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.6 g镁铝合金,投入到500 mL 2 mol/L的盐酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是( )
A.150 mLB.200 mLC.250 mLD.280 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出下列仪器的名称:
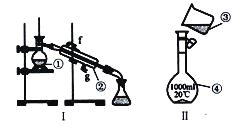
①__________________;②__________________;④__________________;
(2)仪器①~④中,使用时必须检査是否漏水的有_______________(填序号〉
(3)现需配制250 mL0.2mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中两处错误是_____________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将纯净的SO2气体缓缓的通入到盛有25mL0.1mol· L-1的Ba(NO3)2溶液中,得到BaSO4沉淀。为探究该反应中的氧化剂,该小组提出了如下假设:
假设Ⅰ:溶液中的NO3-;
假设Ⅱ:________________。
(1)该小组设计了以下实验验证了假设Ⅰ成立(为排除假设Ⅱ对假设Ⅰ的干扰,在配制下列实验所用溶液时,应___________________),请填写下表。
实验步骤 | 实验现象 | 结论 | |
实验① | 向盛有25mL0.1mol·L-1BaCl2溶液的烧杯中缓慢通入纯净的SO2气体 | ______ | 假设Ⅰ成立 |
实验② | 向盛有25mL0.1mol· L-1Ba(NO3)2溶液的烧杯中缓慢通入纯净的SO2气体 | ______ | |
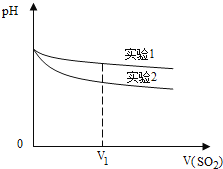
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图。V1时,实验②中溶液pH小于实验①的原因是(用离子方程式表示):________。
(3)验证假设Ⅱ。某同学设计了以下方案,请完成下列表格(可以不填满)。
实验步骤 | 实验现象 | 实验目的 | ||
实验③ | 同实验①步骤 | 同实验①的相关现象 | ______ | |
实验④ | ______ | ______ | ______ | |
(4)查资料知:H2SO3是二元酸(Kl=1.54×10-2,K2=1.02×10-7),请设计实验方案验证H2SO3是二元酸______(试剂及仪器自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据课本实验设计的一个能说明Na2CO3与NaHCO3热稳定性的套管实验。请观察下图的实验装置、分析实验原理,下列说法错误的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明NaHCO3受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 整个实验过程中可以看到丙烧杯的澄清石灰水没变浑浊
D. 同质量的甲和乙分别与足量的盐酸完全反应,产生二氧化碳的质量:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究![]() 等大气污染气体的处理具有重要意义。
等大气污染气体的处理具有重要意义。
(1)已知:![]() ;
;![]() ;
;
则反应![]() 的
的![]() =________。
=________。
(2)一定条件下,将![]() 与
与![]() 以体积比
以体积比![]() 置于密闭容器中发生上述反应,测得上述反应平衡时
置于密闭容器中发生上述反应,测得上述反应平衡时![]() 与
与![]() 体积比为
体积比为![]() ,则平衡常数
,则平衡常数![]() =________(保留两位小数)。
=________(保留两位小数)。
(3)![]() 可用于合成甲醇,反应方程式为
可用于合成甲醇,反应方程式为![]() 。
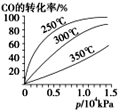
。![]() 在不同温度下的平衡转化率与压强的关系如图所示。该反应
在不同温度下的平衡转化率与压强的关系如图所示。该反应![]() ________
________![]() (填“>”或“<”)。实际生产条件控制在
(填“>”或“<”)。实际生产条件控制在![]() 、
、![]() 左右,选择此压强的理由是__________________。
左右,选择此压强的理由是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com