
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中N的杂化类型为SP | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰分子中C≡N键长大于C≡C键长 |
分析 A.直接连接三键两端原子的原子与三键两端的原子共线,正负电荷重心重合的分子为非极性分子;
B.氰分子的结构式为N≡C-C≡N,根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数;
C.共价单键是σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是π键;
D.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长.
解答 解:A.直接连接三键两端原子的原子与三键两端的原子共线,正负电荷重心重合的分子为非极性分子,该反应中所有原子共线,且该分子的正负电荷重心重合,为非极性分子,故A正确;
B.氰分子的结构式为N≡C-C≡N,氮原子价层电子对个数=σ键个数+孤电子对个数=1+$\frac{1}{2}$(5-3×1)=2,采取sp杂化,故B正确;
C.共价单键是σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是π键,所以氰气分子中含有3个σ键和4个π键,故C正确;
D.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长,碳原子半径大于氮原子,所以氰分子中C≡N键长小于C≡C键长,故D错误;
故选D.
点评 本题考查了物质的组成、结构和性质的关系,同时考查学生知识迁移能力,根据已知的乙炔的结构、卤素的性质结合元素周期律以及杂化理论来分析解答,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 金刚石和纳米管互为同分异构体 | B. | N5和N2互为同素异形体 | ||
| C. | 14C的质子数为14 | D. | C原子半径比N原子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
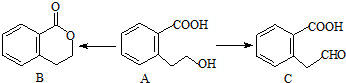
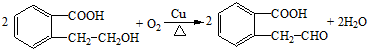 .
.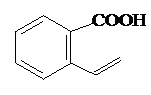 或
或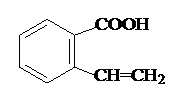 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能和Ca2+生成沉淀的溶液中:Ba2+、K+、CH3COO-、Cl- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、SO32- | |
| D. | 由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol C2H6含有6nA个共价键 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 17gNH3含有10nA个质子 | |
| D. | 1molK被完全氧化生成KO2,失去2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2-、SO42-、Cl-、K+ | B. | Al3+、Ca2+、HCO3-、Na+ | ||
| C. | Fe3+、NH4+、SO42-、SCN- | D. | H+、Cl-、Na+、HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH |  | 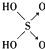 | 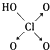 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
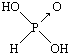 和
和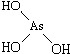 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com