
| 操 作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加人KSCN溶液,振荡 | (1) | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 (2),振荡 | (3) | 存在Fe2+ |
分析 Ⅰ、依据铁离子与硫氰酸钾溶液反应生成血红色溶液验证铁离子的存在,加入KMnO4酸性溶液溶液会和亚铁离子反应,溶液紫色褪去,依据铁和硝酸银溶液反应生成铁离子和亚铁离子分析,银离子氧化性大于铁离子;
Ⅱ、(1)NaCl属于离子化合物,含有离子键,Cl2中氯原子之间形成共价键;
(2)由题目信息可知,SO2与NaCl等物质生成硫酸钠和Cl2,根据S、O原子比例关系可知,应有氧气参与反应,配平书写化学方程式;
Ⅲ、①恰好使溶液中的Cu2+全部转化成沉淀,由N原子守恒可知,原硝酸的物质的量为0.5mol+aV×10-3mol;
②发生Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,混合气体物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,结合电子、原子守恒计算.欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,用双氧水氧化,双氧水得到的电子等于NO、NO2失去的电子,根据电子得失守恒计算.
解答 解:Ⅰ、(1)取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡,若含有铁离子溶液会变血红色,验证亚铁离子实验是取少量除尽Ag+后的溶液于试管中,加入KMnO4酸性溶液溶液会和亚铁离子反应,溶液紫色褪去,说明铁和硝酸银溶液发生反应生成硝酸亚铁,硝酸铁,证明铁离子氧化性小于银离子,
【实验结论】Fe的氧化产物为Fe2+和Fe3+,离子氧化性Ag+>Fe3+,
故答案为:溶液呈红色,酸性KMnO4溶液,紫色褪去;大于;
Ⅱ、(1)NaCl属于离子化合物,含有离子键,Cl2中氯原子之间形成共价键,故答案为:离子键;共价键;
(2)由题目信息可知,SO2与NaCl等物质生成硫酸钠和Cl2,根据S、O原子比例关系可知,应有氧气参与反应,反应化学方程式为2NaCl+SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+Cl2,
故答案为:2NaCl+SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+Cl2;
Ⅲ、①恰好使溶液中的Cu2+全部转化成沉淀,由N原子守恒可知,原硝酸的物质的量为0.5mol+aV×10-3mol,
则原硝酸溶液的浓度为$\frac{0.5+aV×1{0}^{-3}}{0.14}$mol/L=$\frac{500+aV}{140}$mol/L,
故答案为:$\frac{500+aV}{140}$;
②n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,混合气体物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,设NO和NO2的物质的量分别为x、y,由电子、原子守恒可知,
x+y=0.5
3x+y=0.5×2,
解得x=0.25mol,
y=0.25mol,
用双氧水使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,双氧水得到的电子等于NO、NO2失去的电子,设需要双氧水mg,根据电子得失守恒,
有:0.25×3+0.25×1=0.25×4=$\frac{m}{34}$×2,解得:m=17g,
故答案为:17.
点评 本题考查物质的性质及反应原理,为高频考点,把握物质的性质、发生的反应、盖斯定律计算反应热等为解答的关键,侧重元素化合物知识及反应原理的综合考查,题目难度中等.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应的焓变是决定反应能否自发进行的唯一因素 | |
| B. | 温度、压强一定时,放热反应能自发进行 | |
| C. | 固体的溶解过程与焓变无关 | |
| D. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
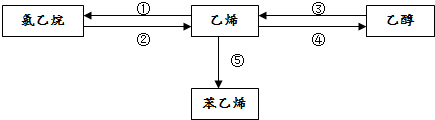
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.72LNO2与水充分反应转移电子数为0.1NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 常温常压下,1mol氦气中含有的核外电子数为2NA | |
| D. | ag某气体含分子数为b,cg该气体在标况下的体积为$\frac{22.4ab}{c{N}_{A}}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产 物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 氧化性由强到弱顺序为MnO4->C12>Fe3+>Br2 | |
| B. | 第①组反应的氧化产物为O2 | |
| C. | 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1:2 | |
| D. | 第③组反应中生成1mol Cl2,转移电子2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②④ | C. | ②④⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| B. | 1L 0.1 mol•L-1 NaHCO3溶液中含有0.1NA个HCO3- | |
| C. | 0.1 mo1铁粉在0.1 mol氯气中充分燃烧,失去的电子数目为0.3NA | |
| D. | 1 mol苯含有6 NA个C-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将氯化铁固体溶于稀盐酸配制FeCl3溶液 | |
| B. | 称取4.0gNaOH,放入100mL容量瓶中,加水稀释,配制1.0mol•L-1的NaOH溶液 | |
| C. | 利用图1装置定量测定H2O2的分解速率 | |
| D. | 如图2所示,关闭弹簧夹检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②⑤ | B. | ②④⑤ | C. | 只有①③ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com