
工业上制造镁粉是将镁蒸气在气体中冷却。可作为却气体的是 ( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①② B.②③ C.③④ D.④⑤
科目:高中化学 来源: 题型:
下列有关试纸的叙述正确的是
A.用干燥洁净的玻璃棒蘸取某溶液,滴在湿润的pH试纸上,跟标准比色卡比较来测定该溶液的pH
B.使湿润的淀粉KI试纸变蓝的气体一定是氯气
C.使湿润的品红试纸褪色的气体必是SO2
D.使湿润的红色石蕊试纸变蓝的气体是氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
为检验下列物质是否已被氧化,所选试剂(括号内物质)不正确的是( )
A.氯化亚铁溶液(硫氰化钾溶液)
B.碘化钾溶液(淀粉溶液)
C.乙醛(紫色石蕊试液)
D.亚硫酸钠溶液(氯化钡溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
 在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量
在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量 之间关系如图所示。则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
之间关系如图所示。则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
( )
A.3∶1 B.1∶2
C.2∶1 D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO 能氧化Ag。
能氧化Ag。
[设计实验方案,验证假设]
(1)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:
________________________________________________________________________。
(2)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② …… | 若银镜消失,假设2成立若银镜不消失,假设2不成立 |
[思考与交流]
(3)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液中离子,能在溶液中大量共存的是: ( )
A.H+、Ca2+、NO3-、CO32- B.K+、Na+、Br-、NO3-
C.Ag+、Na+、Cl-、K+ D.NH4+、K+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
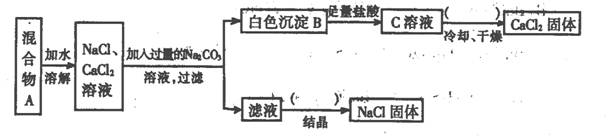 某学生设计了如下实验:
某学生设计了如下实验:
回答下列问题:
(1)该同学的实验目的是 ;
(2)上图括号内的操作步骤均为 ;
(3)按此实验方案得到的NaCl固体中肯定含有 (填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的 ;
(4)写出生成B的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:


实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。


甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氨气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称 。
(2)检查A装置气密性的操作是 。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸、硫酸铵 | 反应的化学方程式为① 。 |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: 。 |
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是 。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将22.4 L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积变为11.2 L(体积均在相同条件下测定),则该氮氧化合物的化学式为( )
A.NO2 B.N2O3 C.N2O D.N2O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com