
| A. | 溶液的溶质质量分数变大 | B. | 溶液仍为饱和溶液 | ||
| C. | 溶液中的Na+数目减小 | D. | 溶液中的c(Na+)增大 |
分析 过氧化钠能与水反应,则饱和的烧碱溶液中的溶剂减少,原饱和溶液有晶体析出,剩余溶液还是饱和溶液,温度不变时,溶液中离子的浓度不变,但数目减少,以此解答该题.
解答 解:过氧化钠与水反应生成NaOH和O2,消耗水,饱和溶液有NaOH晶体析出,反应后仍为饱和溶液,浓度不变,由于溶剂的质量减少,则饱和溶液中的溶质的物质的量减小,所以溶液中Na+数目减少,有固体析出,氧气逸出,溶质的质量分数不变,则A、D错误,B、C正确;
故选BC.
点评 本题考查过氧化钠与水的反应及饱和溶液的变化,侧重考查学生的分析能力,注意把握物质的性质,明确饱和溶液中溶剂减少对溶液的影响是解答本题的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
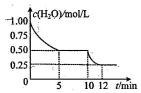 在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )
在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )| A. | 0~5min内,v(H2)=0.05mol/(L•min) | |
| B. | 5min时该反应的K值一定小于12min时的K值 | |
| C. | 10min时,改变的外界条件可能是减小压强 | |
| D. | 5min时该反应的v(正)大于11min时的v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
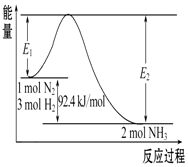 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.| t℃ | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知25℃和101kPa时
(1)已知25℃和101kPa时| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.50 | n1 | 0.34 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
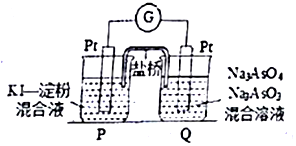 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com