
| A、Na、Mg、Al元素最高化合价依次升高 |
| B、P、S、Cl元素最高价氧化物对应的水化物酸性依次增强 |
| C、N、O、F元素非金属性依次减弱 |
| D、Li、Na、K原子的电子层数依次增多 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:r(B)>r(C)>r(A) |
| B、元素E的氧化物的水化物一定是强酸 |
| C、D单质在一定条件下可以与氧化铁发生置换反应 |
| D、工业上常用电解元素C、D的氯化物来制取它们的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂、淀粉、蛋白质均为可水解的高分子化合物 | ||||
| B、乙烯、苯、乙酸分子中的所有原子都在同一平面上 | ||||
| C、石油催化裂化的主要目的是为了获得汽油等轻质油 | ||||
D、实验室中制取乙酸乙酯的化学方程式为CH3COOH+H18OC2H5
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol/L |
| B、0.6 mol/L |
| C、1 mol/L |
| D、2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
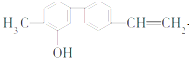
| A、一个分子中含有14个H原子 |
| B、苯环上一氯取代物有2种 |
| C、含有一种含氧官能团 |
| D、分子式是C15H14O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、①③ |
| C、②④⑤ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
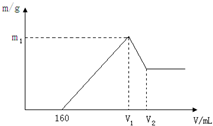 将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com