
| A. | 0.3 mol•L-1的Na2SO4溶液中含有的Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和S${O}_{4}^{2-}$的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol•L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
分析 A.溶液体积不知,利用你的无法接受得到溶质物质的量;
B.气体体积在标准状况下气体摩尔体积为22.4L/mol;
C.溶液中电荷守恒分析判断;
D.温度不变溶液中溶质的溶解度不变,饱和溶液的浓度不变.
解答 解:A.由于不知道溶液体积,无法计算物质的量,不能计算微粒数,故A错误;
B.只有在标况下,气体的摩尔体积才是22.4 L•mol-1,22.4 L氨气温度压强不知,物质的量不一定为1mol,故B错误;
C.K2SO4和NaCl的中性混合水溶液中,c(H+)=c(OH-),存在电荷守恒c(K+)+c(Na+)=c(Cl-)+2c(SO42-),K+物质的量为SO42-的二倍,若Na+和SO42-物质的量相等,则K+的浓度必定大于Cl-的浓度,故C错误;
D.同一物质在同一温度下的溶解度一定,饱和溶液的物质的量浓度恒定,10℃时,0.35 mol•L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1,故D正确;
故选D.
点评 本题考查了气体摩尔体积条件、物质的量浓度概念和计算的应用,注意溶液中溶解度随温度变化,题目难度中等.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W 元素的离子半径依次减小 | |
| B. | W 的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| C. | 若W 与Y的原子序数相差5,则二者形成的化合物的化学式可能为Y2W3或Y3W2 | |
| D. | W 与X形成的化合物只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z) | |
| B. | 气态氢化物的热稳定性:X>Y | |
| C. | 元素X的最高价氧化物对应的水化物是强酸 | |
| D. | 化合物XY、Z2Y、Z2Y2中化学键的类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、CO32- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Ag+、K+、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将铁片置于足量浓硝酸中:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O | |
| B. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 在溶液中FeI2与氯气3:4反应:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| D. | 向Ba(OH)2溶液中加过量的NH4HSO4溶液:Ba2++2OH-+SO42-+H++NH4+═BaSO4↓+H2O+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
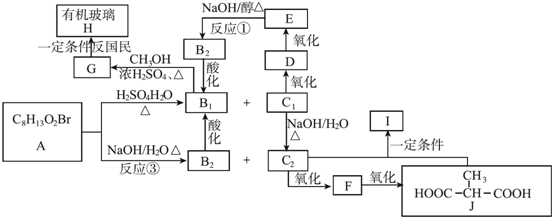
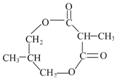 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1 mol NH3含有的电子数10NA | |
| C. | 常温常压下,22.4 L的氧气含氧原子数为2NA | |
| D. | 常温下,1 L0.1 mol•L-1AlCl3溶液中含Al3+数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
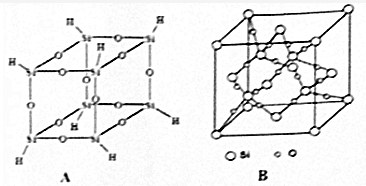
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com