
| A. | 除③外 | B. | 除③⑤外 | C. | 除③④外 | D. | 除⑥外 |
分析 ①C与O2反应充分和不充分时,产物不同;
②Na与O2反应在不同条件下产物不同;
③Cu与浓硝酸反应生成二氧化氮,Cu与稀硝酸反应生成NO;
④AlCl3溶液与NaOH溶液反应分氢氧化钠少量生成氢氧化铝沉淀,氢氧化钠过量生成偏铝酸钠;
⑤少量二氧化碳和烧碱反应生成碳酸盐,二氧化碳过量时生成碳酸氢钠;
⑥金属铁和氯气发生反应生成氯化铁,和量的多少及反应条件无关.
解答 解:①C与O2反应充分时生成二氧化碳,不充分时生成一氧化碳,产物不同,故①正确;
②钠在氧气中加热反应生成过氧化钠,在氧气中常温下反应生成氧化钠,产物不同,故②正确;
③Cu与浓硝酸反应生成二氧化氮,Cu与稀硝酸反应生成NO,反应物硝酸的浓度不同产物不同,故③正确;
④AlCl3溶液与NaOH溶液反应分氢氧化钠少量生成氢氧化铝沉淀,氢氧化钠过量生成偏铝酸钠,产物不同,故④正确;
⑤少量二氧化碳和烧碱反应生成碳酸盐,二氧化碳过量时生成碳酸氢钠,产物不同,故⑤正确;
⑥铁和氯气反应只能将铁氧化为正三价,反应条件、用量、浓度等不同时所发生的化学反应相同,故⑥错误;
故选D.
点评 本题考查浓度及量对反应的影响,侧重元素化合物性质的考查,把握反应的条件、用量的多少、浓度等发生的化学反应为解答的关键,题目难度中等.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 天然气、酒精和汽油分别属于化石能源、不可再生能源和二次能源 | |
| C. | 富含N、P元素的生活用水可以直接用来灌溉农田 | |
| D. | 酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
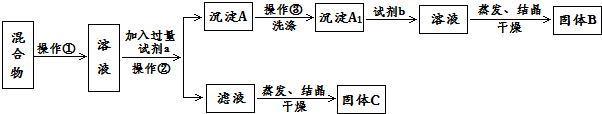
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,判断下列物质不能与B发生化学反应的有C.
,判断下列物质不能与B发生化学反应的有C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
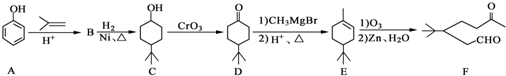
 .
. .同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基.
.同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基. (任写一种).
(任写一种). )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物  的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
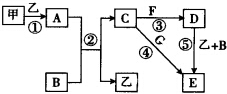 下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com