
����Ŀ����ѡ��3�����ʽṹ�����ʡ�
�ڵ��ұ�����Ĺ����м������ʯ��������Al2O3�۵�����á�����ʯ������ԭ��Ϊ2Al(OH)3+12HF+3Na2CO3�T2Na3AlF6+3CO2��+9H2O�������������������գ�
��1������ʯ�ľ��岻���磬������ʱ�ܵ��磬���ڱ���ʯ�����д���__________(�����)��
a�����Ӽ� b�����Լ� c����λ�� d�����»���
��2��CO2���ӵĿռ乹��Ϊ__________������ԭ�ӵ��ӻ���ʽΪ__________����CO2 ��Ϊ�ȵ��������������__________��
��3����Ӧ���е縺������Ԫ��Ϊ_________(��Ԫ�ط���)��д����ԭ�������ĵ����Ų�ͼ__________��
��4������ʯ�����������ɣ�����ʯ�ľ����ṹ��ͼ����ʾ����λ�ڴ�������Ķ�������ģ���λ�ڴ��������12������е��8��С����������ģ���ô������������Ĵ�������������______(������������)��
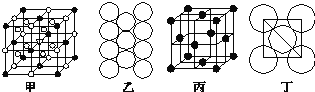
��5��Al���ʵľ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ��
����֪Al��ԭ�Ӱ뾶Ϊd cm��NA��������٤��������Al�����ԭ������ΪM����һ��������Alԭ�ӵ���ĿΪ_________����Al������ܶ�Ϊ__________(����ĸ��ʾ)��
���𰸡���1��abc��2��ֱ���� sp N2O ��3��F ![]() ��4��Na+ ��5��
��4��Na+ ��5��![]() g��cm-3
g��cm-3
��������
�����������1������ʯ(Na3AlF6)���岻���磬������ʱ�ܵ��磬˵���������ӻ������Na+��[AlF6]3-���ɣ�[AlF6]3-�к�����λ����Ҳ���ڼ��Լ�����ѡabc��
��2��CO2����Ϊֱ���νṹ����֪̼ԭ�Ӳ�ȡsp�ӻ���ʽ��ԭ����Ŀ��ȡ��۵�������Ҳ��ȵ�����Ϊ�ȵ����壬��CO2 ��Ϊ�ȵ��������������N2O��
��3��Ԫ�صķǽ�����Խǿ����縺��Խǿ�����Ե縺����ǿ����FԪ�أ�Fԭ�Ӻ����������s��p�ܼ���s��p�ܼ��ϵ��ӷֱ���2��5�������������ʾʽΪ![]() ��
��
��4����ĸ���=8��![]() +6��
+6��![]() =4�������=12��
=4�������=12��![]() +8=11��Ҫʹ�������ӵĸ���֮��Ϊ1��3���������������Ĵ�������������Na+��
+8=11��Ҫʹ�������ӵĸ���֮��Ϊ1��3���������������Ĵ�������������Na+��
��5��������Alԭ�Ӹ���Ϊ=8��![]() +6��
+6��![]() =4��������4��
=4��������4��![]() g����Խ�����3��Alԭ�����ڣ������ⳤΪ4d��
g����Խ�����3��Alԭ�����ڣ������ⳤΪ4d��![]() =2
=2![]() d�����ܶ�=4��
d�����ܶ�=4��![]() =
=![]() g��cm-3��
g��cm-3��


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д� ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����н��������Ĵ�ʩ�У��� ˮ�еĸ�բ�����ӵ�Դ�ĸ���ʹ�õ��� ����
�� ���¸ֹ�����þ��ʹ�õ��� ����
��2��NO2��O2������NaNO3������ȼ�ϵ��,��ԭ������ͼ��ʯī��Ϊ��ص� �����õ����ʹ�ù�����ʯī��缫������������Y����缫��ӦʽΪ ��

��3���Լ���Ϊȼ�ϵ����͵�أ���ɱ�������������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�صĹ���ԭ��ʾ��ͼ���ش��������⣺

�� A��Ϊ��� �����缫��ӦʽΪ ��

�� ���ø�ȼ�ϵ������Դ����ʯī���缫���100 mL 1 mol��L-1������ͭ��Һ���������ռ���������������ʱ�����������ĵļ�������Ϊ (��״����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸ��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯����ͼ��ʾ��

�����жϳ���Ԫ�ػش����⣺
��1��y��Ԫ�����ڱ��е�λ����_______��z��d��e��f����Ԫ�صļ������У��뾶��С����______�������ӷ��ţ���
��2��g��h�⻯����ȶ����ɴ�С��˳��_______���û�ѧʽ��ʾ����
��3��Ԫ��e��g��ͬ��Ԫ���а뾶��СԪ����ɵĻ�����B�����Ӱ뾶�ϴ����______�������ӷ��ţ���
��4�����п���Ϊ�Ƚ�f��Na�������ǿ����������____��������ţ�
a��������Ԫ�ص��ʵ�Ӳ�Ⱥ��ۡ��е�
b���Ƚ���Ԫ������������Ӧ��ˮ������Һ�ļ���ᣩ��ǿ��
c���Ƚ�����Ԫ�����Ȼ����л��ϼ۵ĸߵ�
d���Ƚϵ�����ͬŨ�����ᷴӦ�ľ��ҳ̶�
��5�����˽��齫��Ԫ������Ԫ�����ڱ���IVA�壬����ӻ��ϼ۵ĽǶȸ���һ������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ---ѡ��3�����ʽṹ�����ʡ�ԭ������С��36��X��Y��Z��W����Ԫ�أ�����X�ǰ뾶��С��Ԫ�أ�Yԭ�ӻ�̬ʱ���������������ڲ����������2����Zԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵĵ��ӣ�Wԭ��4sԭ�ӹ������1�����ӣ�M�ܲ�Ϊȫ�����ı��ͽṹ���ش��������⣺

��1��W��̬ԭ�ӵļ۵����Ų�ʽ____________��Y2X2������Yԭ�ӹ�����ӻ�����Ϊ______��
��2��������ZX3�ķе�Ȼ�����YX4�ĸߣ�����Ҫԭ����_____________��
��3��Ԫ��Y��һ����������Ԫ��Z��һ�������ﻥΪ�ȵ����壬Ԫ��Z������������ķ���ʽ��____________��Y60�����Ƚ�������Ͻ��Ϊ��Ч������������ϣ�����ӽṹΪ����32���壬������60��Yԭ����20����Ԫ����12����Ԫ�����Ӷ��ɵľ���30��Y=Y��������״���ĶԳƷ��ӡ���÷������Ҽ��ͦм��ĸ�����_____��36gY60���������ձ�״���µ�����_____L��
��4��Ԫ��W��һ���Ȼ��ᄃ��ľ����ṹ����ͼ��ʾ�����Ȼ���Ļ�ѧʽ��___________���þ�����W����λ��Ϊ___________��������Ũ���ᷢ����������ԭ��Ӧ�����������HnWCl3����Ӧ�Ļ�ѧ����ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ---ѡ��2����ѧ�뼼����ˮ������֮Դ��ˮ��Ʒ�ʶ��ڽ�������ʮ����Ҫ�����塣��ѧ��ȤС���ijɽȪˮ���з�������,�����ʾˮ��Ӳ��Ϊ28��(����Ӳˮ),��Ҫ�������ӡ�þ���ӡ������Ӻ���������ӡ���˼����������:
��1����Ȫˮ���� Ӳˮ(��д����ʱ�������á�)��
��2����Ҫ��ȥCa2+��Mg2+������ˮ�м���ʯ�Һʹ���,�Լ�����ʱ�ȼ� ��� ��ԭ���� ��
��3��Ŀǰ���������ӽ�����֬��NaR��HR������ˮ������,��ʹ��HR��Ϊ�����ӽ�����֬��ˮ�е�Ca2+��Mg2+�뽻����֬�� �����ӽ������á���ʹ��NaR��Ϊ�����ӽ�����֬ʧЧ��ɷ���5%-8% ��Һ��������
��4����ˮ�����ǻ�õ�ˮ����Ҫ��Դ�������Ǻ�ˮ���õ���������õ�ˮ��ԭ��ͼ,��֪��ˮ�к�Na+��Cl-��Ca2+��Mg2+��S![]() ������,�缫Ϊ���Ե缫���������������:
������,�缫Ϊ���Ե缫���������������:

�������ӽ���Ĥ��ָ (��A��B)��
��д��ͨ����������ĵ缫��Ӧʽ ����������������: ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĸ���ͬ�����У���ͬ�����½��кϳɰ���Ӧ����������ͬʱ���ڲⶨ�Ľ���ж����ɰ�������������( )
A��v(N2)=0.1molL��1s��1 B��v(H2)=0.1molL��1min��1
C��v(NH3)=0.15molL��1min��1 D��v(H2)=0.3molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯����������������������Ҫ����;���ش��������⣺
I ��1��ֱ������������n���������ͨ�����Ӽ���ˮ�γɵģ���������ȡ��ȼ��������李�
��д��������Ҫ�ĵ��뷽��ʽ________________________��
��ֱ���;�����淋Ļ�ѧʽ�ɱ�ʾΪ(NH4)(n+2)PnOx��x=_____(��n��ʾ)��
��2���ڼ��������£��������ο����ڻ�ѧ����������䷴Ӧ�����ӷ���ʽ��
��H2PO2��+��Ag++��______=��PO43��+��Ag+��______
��3�� ��ҵ����������ͭ���������ͼ���£�

���ڲ���a�У���Ҫͨ��������ˮ����Ŀ����______��
�ڽ�������Ũ��ʱ��Ҫ�����������Һ��pH=1����Ŀ����(������ӷ���ʽ˵��)______��
����ͼ��ijС��ͬѧ�������������������ͭ����[Cu(NO3)2nH2O]���ܽ������(�¶���30��ǰ���Ӧ��ͬ�ľ���)������˵����ȷ����______(����ĸ)��

a��A��ʱ����ҺΪ��������Һ
b��B��ʱ���־�����Թ���
c���������������յõ��ľ�����Cu(NO3)23H2O
d������C��ʱ����Һ������30�����£���������Cu(NO3)26H2O����
II ��4���������Ͽ�֪��������Һ�д���ƽ�⣺Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq)���÷�Ӧƽ�ⳣ���ı���ʽK��[Ag(NH3)2+]= _________����֪ij�¶��£�K��[Ag(NH3)2+]=1.10��107��Ksp[AgCl]=1.45��10��10������õ����淴ӦAgCl(s)+2NH3(aq)
Ag(NH3)2+(aq)���÷�Ӧƽ�ⳣ���ı���ʽK��[Ag(NH3)2+]= _________����֪ij�¶��£�K��[Ag(NH3)2+]=1.10��107��Ksp[AgCl]=1.45��10��10������õ����淴ӦAgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl��(aq)�Ļ�ѧƽ�ⳣ��K=_________ (����2λ��Ч����)��1L 1mol��L��ˮ���������ܽ�AgCl_________mol(����1λ��Ч����)��
Ag(NH3)2+(aq)+Cl��(aq)�Ļ�ѧƽ�ⳣ��K=_________ (����2λ��Ч����)��1L 1mol��L��ˮ���������ܽ�AgCl_________mol(����1λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���F�ĺϳ�·����ͼ��ʾ��

��֪������Ϣ��
��1��RCOOR��![]() RCH2OH
RCH2OH
��2��
�ش��������⣺
��1��A�Ľṹ��ʽΪ ��G�Ľṹ��ʽΪ ��
��2��B����C�Ļ�ѧ����ʽΪ ��
��3������E�к��������ŵ��Լ��� ��
��Ӧ������ ��
��4��E��F�ķ�Ӧ������ ��
��5��A��ͬ���칹���У���������������ͬ���칹���� ��(������A)��д������һ�ֵĽṹ��ʽ ��
�����ڷ����廯����
�����������ĸ�ȡ����
�������ϵ�һ��ȡ����ֻ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ų���������[��Ҫ����BaCO3��BaSO3��Ba(FeO2)2��]��ij����������Դ���úͽ��������ɱ���Ŀ�ġ�������BaCO3ͬʱ��������ñ�������ȡBa(NO3)2���弰��������Ʒ���䲿�ֹ����������£�

��֪�� ��Fe(OH)3��Fe(OH)2��ȫ����ʱ��Һ��pH�ֱ�Ϊ3.2��9.7
��Ba(NO3)2����ˮ�е��ܽ�ȴ�������ˮ�е��ܽ��С
��Ksp(BaSO4)=1.1��10-10 Ksp(BaCO3)=5.1��10-9
��1���ó�������BaCO3��������BaSO4���������ᴿ�ķ�����������Ʒ�����������͵�Na2CO3��Һ�г�ֽ��衢���ˡ�ϴ�ӡ������ӷ���ʽ˵�����ᴿ��ԭ�� ��
��2������������Ba(FeO2)2��HNO3��Һ��Ӧ���������Σ���Ӧ�Ļ�ѧ����ʽΪ ��
��3����ϱ�������ʵ����X�Լ�Ӧѡ�����е� ��
A��BaCl2 B��BaCO3 C��Ba(NO3)2 D��Ba(OH)2
��4������2Ϊ ��
��5������IIIΪ ��
��6������III���ĸҺӦѭ�������� ��(ѡ��a��b��c) ��
��7����ȡw�˵ľ�����Ʒ��������ˮ�м���������ϡ���ᣬ��Ӧ��һϵ�в����������ó�������Ϊm�ˣ���þ���Ĵ��ȿɱ�ʾΪ______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com