
| A. | 乙醇>丙烷 | B. | 甲烷>戊烷 | C. | 1-丁烯>1-庚烯 | D. | 乙二醇>丙三醇 |
分析 烷烃都是分子晶体,烷烃熔沸点与其相对分子质量成正比,碳原子个数相等的烷烃,含有支链越少的熔沸点越高,醇中含有氢键,导致碳原子个数相同的醇熔沸点高于烷烃,醇中羟基个数越多其熔沸点越高,据此分析解答.
解答 解:烷烃都是分子晶体,烷烃熔沸点与其相对分子质量成正比,碳原子个数相等的烷烃,含有支链越少的熔沸点越高,醇中含有氢键,导致碳原子个数相同的醇熔沸点高于烷烃,醇中羟基个数越多其熔沸点越高,
A.乙醇中含有氢键、丙烷不含氢键,所以熔沸点乙醇>丙烷,故A正确;
B.甲烷含有一个碳原子、戊烷含有5个碳原子,所以熔沸点甲烷<戊烷,故B错误;
C.1-丁烯中含有4个碳原子、1-庚烯中含有7个碳原子,所以熔沸点1-丁烯<1-庚烯,故C错误;
D.乙二醇中含有两个羟基、丙三醇中含有3个羟基,所以熔沸点乙二醇<丙三醇,故D错误;
故选A.
点评 本题考查有机物熔沸点高低判断,烷烃和烯烃中熔沸点与碳原子个数及支链有关、醇中熔沸点与羟基个数有关,注意氢键对物质熔沸点影响,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:填空题
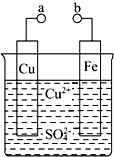 某小组为研究电化学原理,设计如图装置.请回答下列问题:
某小组为研究电化学原理,设计如图装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 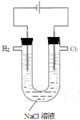 用甲制取少量氯气 | B. | 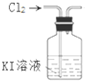 用乙氧化溶液中的碘离子 | ||
| C. | 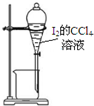 用丙提取置换出来的碘 | D. | 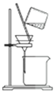 用丁过滤I2的CCl4溶液得碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
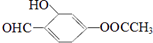 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的分子式为:C9H8O4 | |
| B. | M与乙酸苯乙酯互为同系物 | |
| C. | M可发生水解反应、加成反应、氧化反应 | |
| D. | 1mol M可与3mol NaOH和2mol Br2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃容器可长期盛放各种酸 | B. | P2O5可用于干燥Cl2和NH3 | ||
| C. | Si和SiO2都用于制造光导纤维 | D. | Na2S可除去污水中的Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
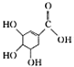 )和鞣酸(
)和鞣酸(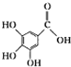 )的叙述中,正确的是( )
)的叙述中,正确的是( )| A. | 两种有机物中含有完全相同的官能团 | |
| B. | 两种酸都能与溴水反应,且反应类型相同 | |
| C. | 分别向两种酸中滴加三氯化铁溶液,均发生显色反应 | |
| D. | 等物质的量的两种酸与NaOH反应,消耗NaOH的量不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com