
反应A(g)+3B(g)  2C(g)+2D(g),在不同情况下测得反应速率,其中反速率最快的是 ( )
2C(g)+2D(g),在不同情况下测得反应速率,其中反速率最快的是 ( )
A.υ(D)=0.4 mol / ?L·s? B.υ(C)=0.5 mol / ?L·s?
C.υ(B)=0.6 mol / ?L·s? D.υ(A)=0.15 mol / ?L·s?
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源:2016-2017学年江西省南昌市等五校高一上联考二化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是( )
A.在H2SO4溶液中滴入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
D.醋酸溶解鸡蛋壳:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上期中化学卷(解析版) 题型:选择题
下列反应的离子方程式正确的是( )
A.NaHCO3溶液与盐酸:CO32?+2H+ H2O+CO2↑
H2O+CO2↑
B.将少量的 铜屑放入硝酸银溶液中:Cu+2Ag+
铜屑放入硝酸银溶液中:Cu+2Ag+ Cu2++2Ag
Cu2++2Ag
C.用醋酸溶液除水垢:2H++CaCO3 Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
D.Ca(HCO3)2溶液与过量NaOH溶液:Ca2++HCO3?+OH? H2O+CaCO3↓
H2O+CaCO3↓
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:填空题
(1)已知:①2Fe(s)+O2(g)=2 FeO(s)△H1=﹣544.0kJ•mol﹣1;
②4Al(s)+3O2(g)═2Al2O3(s)△H2=﹣3351.4kJ•mol﹣1。
Al和FeO发生铝热反应的热化学方程式是
(2)反应物与生成物均为气态的 某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
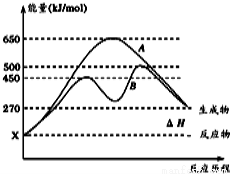
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为 (填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ•mol﹣1,该反应的活化能为334.4kJ•mol﹣1,则其逆反应的活化能为  。
。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
下列关于强、弱电解质的叙述,正确的是( )
A.稀硫酸是强电解质
B.弱电解质在水溶液中一定不能完全电离
C.强电解质的水溶液中不存在分子
D.弱电解质溶液的导电能力一定很弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
强酸和强碱稀溶液的中和热可表示为
H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol
①HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l) △H=﹣akJ/mol
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) △H=﹣bkJ/mol
③Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) △H=﹣ckJ/mol
则a,b,c三者的大小关系判断错误的是( )
A.c>114.6 B.a<57.3 C.b>57.3 D.2a=2b=c
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:选择题
在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是( )
A.两种气体A与B的相对分子质量之比为m:n
B.同质量气体A与B的分子数之比为n:m
C.同温同压下,A、 B两气体的密度之比为n:m
D.相同状况下 ,同体积A、B两气体的质量之比为m:n
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:实验题
在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[ Na2C2O4 相对分子质量=134.0 ]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为: 5C2O42-+2MnO4-+16H+===10CO2↑+2Mn2++8H2O以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol/L的KMnO4溶液500mL。
步骤二:准确称取Na2C2O4固体mg放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配KMnO4溶液进行滴定。记录相关数据。
步骤三: 。
步骤四:计算得KMnO4溶液的物质的量浓度。
试回答下列问题:
(1)下左图为整个过程中可能使用的仪器的部分结构(有的仪器被放大),
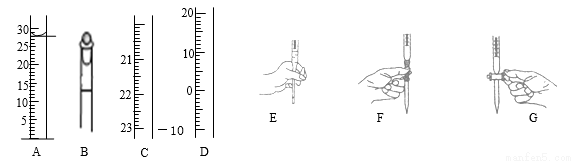
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量某液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
(2)该滴定实验滴定终点的现象是 。
(3)步骤二中滴定操作图示(上右图)正确的是 (填编号)。
(4)步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色中间明显变快,最后又变慢的原因是 。
(5)请写出步骤三的操作内容 。
(6)若m的数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为 mol/L。
(7)若滴定完毕后读数时俯视,则实验误差为 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:选择题
用下列装置完成相关实验,合理的是( )
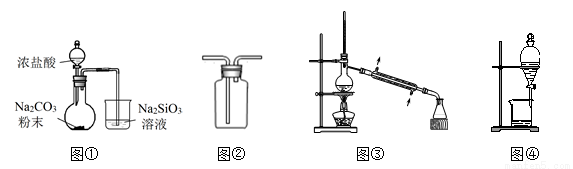
A.图①:验证H2CO3酸性强于H2SiO3
B.图②:收集CO2或NH3
C.图③:分离Na2CO3溶液与CH3COOC2H5
D.图④:分离CH3CH2OH与CH3COOC2H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com