
| 消耗量 |
| 起始量 |
| (2.2×10-2)2 |
| (3.0×10-3)2×4.0×10-3 |
| 2.2×10-2 |
| 2.5×10-2 |


科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | ||||
B、用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
| ||||
| C、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | ||||
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
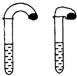 (1)高中教材中有这样一个实验:如图,在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:如图,在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 2.5g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10mL水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 2.5g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
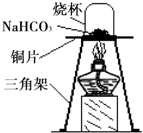 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. | ||
| 固体产物是NaOH,而不是Na2CO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2 |
| B、CH4 |
| C、CO |
| D、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com