
科目:高中化学 来源:不详 题型:填空题
| 矿石名称 | 磁铁矿 | 黄铁矿 | 赤铁矿 | 黄铜矿 |
| 主要成分 | Fe3O4 | FeS2 | Fe2O3 | CuFeS2 |
 2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。
2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.镁和铁 | B.镁和铝 | C.铁和锌 | D.钠和镁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铁与过量氨水 Fe3++3OH-====Fe(OH)3↓ |
| B.氧化铁与稀HNO3 Fe2O3+6H+====2Fe3++3H2O |
| C.溴化亚铁通入足量Cl2 2Fe2++Cl2====2Fe3++2Cl- |
| D.铁与稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
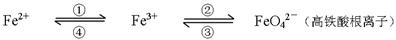
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②④⑤ | B.①③⑥ | C.①②⑥ | D.①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.线段BD表示Fe3+物质的量的变化 |
| B.原混合溶液中FeBr2的物质的量为6mol |
| C.当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com