
【题目】在标准状况下,由氧气和氯气组成的混合物气体共560 mL,向其中通入H2,在一定条件下,使其恰好完全燃烧,用水吸收所得到产物后制得250 mL溶液。从中取出25 mL溶液与20 mL 0.125 mol·L-1氢氧化钠溶液反应恰好中和,则与混合气体反应的H2的体积为( )
A. 840 mL B. 720 mL C. 500 mL D. 280 mL
【答案】A
【解析】25mL溶液中所含HCl物质的量等于消耗的NaOH物质的量,n(HCl)=n(NaOH)=0.125mol/L![]() 0.02L=0.0025mol;250mL溶液中含HCl物质的量为0.025mol;根据反应H2+Cl2
0.02L=0.0025mol;250mL溶液中含HCl物质的量为0.025mol;根据反应H2+Cl2![]() 2HCl,生成0.025molHCl消耗0.0125molH2和0.0125molCl2;n(O2)=
2HCl,生成0.025molHCl消耗0.0125molH2和0.0125molCl2;n(O2)=![]() -0.0125mol=0.0125mol;根据反应2H2+O2
-0.0125mol=0.0125mol;根据反应2H2+O2![]() 2H2O,O2消耗的H2物质的量为0.025mol;与混合气体反应的H2共0.0125mol+0.025mol=0.0375mol,在标准状况下的体积为0.0375mol
2H2O,O2消耗的H2物质的量为0.025mol;与混合气体反应的H2共0.0125mol+0.025mol=0.0375mol,在标准状况下的体积为0.0375mol![]() 22.4L/mol=0.84L=840mL,答案选A。
22.4L/mol=0.84L=840mL,答案选A。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
【题目】将一定体积密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止。已知反应后所得溶液的质量等于原BaCl2溶液的质量,则原硫酸溶液浓度约为( )
A. 23.9% B. 11.0% C. 13.5mol/L D. 5.67mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“同位素示踪法,可帮助人们认识化学反应的机理。下列反应中同位素示踪表示正确的是
A. 2Na2O2+2H218O=4NaOH+18O2↑
B. K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
C. NH4Cl+2H2O![]() NH3·2H2O+HCl
NH3·2H2O+HCl
D. CH3COOH + CH3CH218OH![]() CH3CO18OCH2CH3 + H2O
CH3CO18OCH2CH3 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2.

实验操作和现象如下表:
实验编号 | 操作 | 现象 |
实验1 | 按上图所示加热MnO2与FeCl3·6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验2 | 把A中的混合物换为FeC13·6H2O, B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
(l)上述实验中的白雾是_______;试管A管口向上倾斜的原因是_________
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI-淀粉溶液变蓝的离子方程式:___
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+。则方案1 C中盛放的试剂是_________;方案2中检验Fe2+的试剂是______,选择NaBr溶液的依据是______。
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为_______;其尾气处理的方法是_________。
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:___________。请你设计实验方案验证此猜想:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

回答下列问题:
(1)A的化学名称为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物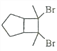 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为分析矿物X中的常见离子,将其溶于稀硝酸,并将所得溶液进行实验,下列依据实验现象得出的结论正确的是
A. 用铂丝蘸取少量溶液进行焰色反应,火焰呈黄色,说明矿物X中不含K+
B. 取少量溶液向其中滴加NaOH溶液,加热,用湿润红色石蕊试纸检验生成的气体,试纸变蓝,说明矿物X中含NH![]()
C. 取少量溶液向其中滴加KSCN溶液,溶液变为红色,说明矿物X中含Fe3+
D. 取少量溶液向其中滴加盐酸酸化的BaCl2溶液,有白色沉淀产生,说明矿物X中含SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物是同学们经常能接触到的重要物质,是科学研究的重要对象。
(1)实验室制取乙炔的化学方程式为___________________________。
(2)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图A所示。用CO2和氨气合成尿素的热化学方程式为___________________________。

(3)合理利用CO2、CH4,抑制温室效应成为科学研究的新热点。一种以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸(△H<0)。在不同温度下催化剂的催化效率与乙酸的生成速率分别如上图B所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。250℃和400℃时乙酸的生成速率几乎相等,实际生产中应选择的温度为_________℃。
(4)T℃时,将等物质的量的NO和CO充入体积为2L的 密闭容器中发生反应2NO+2CO![]() 2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。

①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将______(填“向左”、“向右”或“不”)移动。
②图中a、b分别表示在一定温度下,使用相同质量、不同表面积的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____________(任答一条即可)。
(5)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,可用电解原理将溶液中的氨氮物质完全氧化除去。该过程分为两步:第一步:电解产生氯气;第二步:利用氯气将氨氮物质氧化为N2。
①第二步反应的化学方程式为____________________。
②若垃圾渗滤液中氨氮物质的质量分数为0. 034% ,理论上用电解法净化It该污水,
电路中转移的电子数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com