
【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用____润洗。
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面。如果液面初始位置如图所示,则此时的读数为____mL。
![]()
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察____(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
初读数 | 末读数 | 消耗体积 | ||
1 | 15.00 | 0.50 | 17.75 | ____ |
2 | 15.00 | 0.05 | 16.10 | 16.05 |
3 | 15.00 | 0.00 | 15.95 | 15.95 |
(4)请填写1组反应消耗的氢氧化钠溶液体积。
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是___mL。若NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为___mol/L。
(6)在本实验过程中,下列操作不会造成实验误差的是___(选填编号)。
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定
【答案】氢氧化钠溶液 0.70 b 17.25 16.00 0.1088mol/L a
【解析】
(1)滴定管使用前应用待装液润洗,以防止被稀释,
故答案为:NaOH标准溶液;
(2)滴定管液面的读数0.70mL,
故答案为:0.70;
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化,根据溶液颜色的变化判断终点;
答案选b;
(4)初读数0.50mL,末读数17.75mL,则消耗氢氧化钠溶液体积为17.25mL;
故答案为:17.25;
(5)三次滴定消耗标准液体积分别为:17.251mL、16.05mL、15.95mL,第一组数据误差较大,应该舍弃,另外两组实验中消耗标准液平均体积为:![]() =16.00mL,
=16.00mL,
NaOH~HCl
0.1020mol/L×16.00mL c(HCl)×15.00mL
解得:c(HCl)=0.1088mol/L
故答案为:16.00;0.1088;
(6)a.锥形瓶中加入待测溶液后,再加少量蒸馏水,导,待测液的物质的量不变,标准液的体积不变,结果不变,故a错误;
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=![]() 分析,可知c(待测)偏小,故b错误;
分析,可知c(待测)偏小,故b错误;
c.见到指示剂的颜色有变化即停止滴定,造成V(标准)偏小,根据c(待测)=![]() 分析,可知c(待测)偏小,故c错误;
分析,可知c(待测)偏小,故c错误;
答案选a。


科目:高中化学 来源: 题型:
【题目】工业上研究高效处理煤燃烧释放出来的SO2,有利于减小环境污染。在T℃时,利用CO处理SO2的反应为:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H=akJ/mol;
2CO2(g)+S(l) △H=akJ/mol;
(1)已知T℃时:C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol
S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol
C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
则T℃时,a=___。
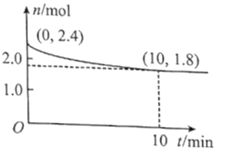
(2)在T℃下,将1.4molCO和1molSO2通入2L恒容容器中发生上述反应,反应体系气体总物质的量随时间变化如图;在0~10min,反应的平均速率v(CO)=___,SO2的平衡转化率![]() (SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
(SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
(3)实验测得:v正=v(CO)消耗=k正c(CO)c(SO2),v逆=v(CO2)消耗=k逆![]() ,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),
,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),![]() 的值将___(填“增大”、“减小”或“不变”)。
的值将___(填“增大”、“减小”或“不变”)。
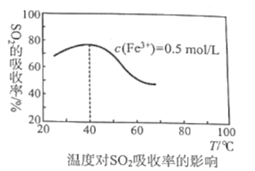
(4)某科研团队研究用Fe2(SO4)3(aq)处理SO2:Fe3+溶液吸收SO2发生的离子反应方程式为___;其他外界条件不变下,在相同时间内温度对SO2吸收率的影响结果如图,在40℃前,SO2的吸收率随温度变化的可能原因是___;在40℃后,SO2的吸收率发生的变化是温度升高该反应逆向移动的结果,导致反应逆向移动的原因:一是该反应为放热反应,二是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
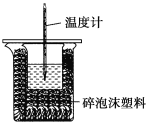
【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A. 常温常压下,8gO2和O3的混合气体含有4NA个电子
B. 1L0.1mol/L的FeCl3完全水解,形成0.1NA个Fe(OH)3胶体粒子
C. 标准状况下,22.4LCl2通入水中发生反应,转移的电子数为NA
D. 1molNa被完全氧化生成Na2O2,失去个2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙、丁、戊五种烃,已知他们是C2H6、C3H6、C2H2、C6H6、C6H12(环己烷),实验现象如下:
①甲、乙能使溴水因化学反应而褪色;②0.5mol甲能与1molH2生成丙,丙不能使溴水和酸性高锰酸钾溶液褪色;③戊可由丁在一定条件下与氢气反应得到。④比乙少一个碳原子的相邻同系物可以在一定条件下和H2O反应得到W,W和醋酸反应会生成一种有香味的油状液体。
(1)这五种烃分别是:甲是____(写电子式);乙是____(写结构简式);丙是____(写结构式);丁是____(写名称)。
(2)写出下列化学方程式:
乙和溴水的反应:______。
实验室制备甲的反应:______。
④中制得香味油状液体的反应:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
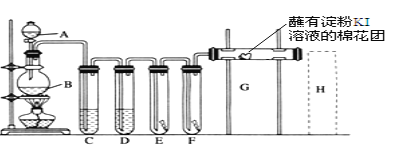
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式___________。
(2)D中放入浓H2SO4,其目的是________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是________,对比E和F中现象的差异可得出的结论及解释____________________________。
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______,反应的离子方程式是______________,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成______。
(5)画出H处尾气吸收装置图并注明试剂________。
(6)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯浄Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.1L0.1molL-1NaNO2溶液中NO2-的数目为0.1NA
B.3.1g乙二醇中含有羟基的数目为NA
C.5.85gNa37Cl中所含质子总数为2.8NA
D.2.4g镁条在足量的由N2和O2组成的混合气体中完全燃烧时,转移的电子总数一定为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com